Hvorfor er elementerne klassificeret i Kl M N -blokke og S P D F Sub Block?
Her er en sammenbrud af, hvordan det fungerer:
1. Energiniveau (K, L, M, N ...):
* hovedkantenummer (n): Hver blok repræsenterer et energiniveau (også kaldet en elektronskal). Jo højere værdien af n, jo yderligere er elektronet fra kernen og jo højere dens energi.
* k (n =1), l (n =2), m (n =3), n (n =4) ...: Disse breve er simpelthen kortfattet for de forskellige energiniveauer.
2. Subnles (S, P, D, F):
* vinkelmomentumnummer (L): Inden for hvert energiniveau er der sublevels karakteriseret ved forskellige former og energier.
* s (l =0): Sfærisk form, laveste energi inden for hvert energiniveau.
* p (l =1): Håndvægtform, lidt højere energi end s.
* d (l =2): Mere kompleks form, højere energi end p.
* f (l =3): Endnu mere kompleks form, højeste energi inden for hvert energiniveau.
hvordan det relaterer til den periodiske tabel:
* Perioder: Hver række (periode) i den periodiske tabel svarer til et specifikt energiniveau (K, L, M osv.). Så alle elementer i samme række har det samme højeste energiniveau for deres yderste elektroner.
* grupper: Hver kolonne (gruppe) i den periodiske tabel svarer til et specifikt underniveau (S, P, D, F). Elementer i den samme gruppe har det samme antal valenselektroner (elektroner i det yderste underniveau).
* blokke: Arrangementet af elementer i den periodiske tabel baseret på deres underniveauer kaldes blokklassificering :
* s-blok: De to første søjler (grupper 1 &2) består af elementer, hvis yderste elektroner er i S -sublet.
* p-blok: De sidste seks søjler (grupper 13 til 18) indeholder elementer med deres yderste elektroner i P -sublet.
* d-blok: De ti søjler i midten (grupper 3 til 12) omfatter elementer med deres yderste elektroner i D -sublet.
* f-blok: De to rækker i bunden af den periodiske tabel (lanthanider og actinider) er elementer med deres yderste elektroner i F -underniveauet.
Hvorfor er denne klassificering vigtig?
* Forudsigelse af kemiske egenskaber: Elementer inden for den samme blok har lignende kemiske egenskaber på grund af at have lignende elektronkonfigurationer, især i deres valenselektroner.
* Forstå periodiske tendenser: Blokklassificeringen hjælper med at forklare tendenser i atomstørrelse, ioniseringsenergi, elektronegativitet og andre egenskaber på tværs af den periodiske tabel.
* Elektronkonfiguration og limning: At kende elektronkonfigurationen af et element giver os mulighed for at forudsige, hvordan det vil binde til andre elementer og danne forskellige kemiske forbindelser.
Sammenfattende er K L M N-blokke og S P D F-underblokke vigtige for at organisere og forstå opførelsen af elementer baseret på deres elektronkonfigurationer. Dette klassificeringssystem giver en ramme for at forudsige deres kemiske egenskaber og forstå deres rolle i den periodiske tabel.
 Varme artikler
Varme artikler
-
 Bakteriefabrikker bruges til at opdage potentielle nye malariamedicinDerivater af violacein. Kredit:Hung-En Lai Forskere har konstrueret bakterier til at producere nye versioner af et potentielt antibiotisk molekyle, nogle med kraftige antimalariaegenskaber. Brug
Bakteriefabrikker bruges til at opdage potentielle nye malariamedicinDerivater af violacein. Kredit:Hung-En Lai Forskere har konstrueret bakterier til at producere nye versioner af et potentielt antibiotisk molekyle, nogle med kraftige antimalariaegenskaber. Brug -
 Forskere udvikler en effektiv metode til at skabe højstyrkematerialer til fleksibel elektronikTPU-forskerne Raul David Rodriguez Contreras og Evgeniya Sheremet. Kredit:Tomsk Polytekniske Universitet TPU-forskere har sammen med deres kolleger fra udenlandske universiteter udviklet en metode
Forskere udvikler en effektiv metode til at skabe højstyrkematerialer til fleksibel elektronikTPU-forskerne Raul David Rodriguez Contreras og Evgeniya Sheremet. Kredit:Tomsk Polytekniske Universitet TPU-forskere har sammen med deres kolleger fra udenlandske universiteter udviklet en metode -
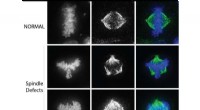 Afdækning af en ny mekanisme i celledelingI kræftceller, defekter i den bipolære spindel fører til at trække kromosomer i flere retninger under celledeling. Kredit:Northwestern University Northwestern Medicine-forskere har afsløret den ro
Afdækning af en ny mekanisme i celledelingI kræftceller, defekter i den bipolære spindel fører til at trække kromosomer i flere retninger under celledeling. Kredit:Northwestern University Northwestern Medicine-forskere har afsløret den ro -
 At reducere salt i Parmigiano Reggiano-ost påvirker muligvis ikke dens smag negativtKredit:CC0 Public Domain Lagrede oste pakker en punch af nøddeagtig, skarp smag. Før de er helt modne, lagrede oste enten vokses eller placeres i saltlage i uger for at skabe en naturlig svær. Imi
At reducere salt i Parmigiano Reggiano-ost påvirker muligvis ikke dens smag negativtKredit:CC0 Public Domain Lagrede oste pakker en punch af nøddeagtig, skarp smag. Før de er helt modne, lagrede oste enten vokses eller placeres i saltlage i uger for at skabe en naturlig svær. Imi
- Levelland UFO -stævne i 1957
- Sådan fungerer Storm Chasers
- En protokol til at minimere de termodynamiske omkostninger ved sletning af en enkelt bit over en giv…
- Farlige forurenede områder i Nord- og Østersøen
- Forvent mere dødbringende varme fra klimaændringer, undersøgelse siger
- Mikroskopi afslører mekanismen bag det nye CRISPR-værktøj


