Hvad sker der, hvis natriumion sprøjtes over flammen?
Sådan fungerer det:
1. excitation: Flammen fra flammen ophidser natriumionerne og får deres elektroner til at hoppe til højere energiniveau.
2. de-excitation: De ophidsede elektroner er ustabile og vender hurtigt tilbage til deres jordtilstand. Som de gør, frigiver de den absorberede energi i form af lys.
3. Specifik bølgelængde: Den frigivne energi svarer til en bestemt bølgelængde af lys, som i tilfælde af natrium er i den gule del af det synlige spektrum.
Praktiske applikationer:
* flammeforsøg: Denne egenskab bruges i kemi til at identificere tilstedeværelsen af natrium i en prøve.
* gadelys: Natriumdamplamper bruger dette princip til at producere et lysegult lys.
* fyrværkeri: Natriumforbindelser bruges i fyrværkeri til at skabe gule farver.
Sikkerhedsforholdsregler:
* Natrium er et reaktivt metal og kan være farligt. Det er vigtigt at håndtere det med forsigtighed og bære passende sikkerhedsudstyr.
* Forsøg ikke at udføre dette eksperiment uden korrekt overvågning og sikkerhedsforholdsregler.
 Varme artikler
Varme artikler
-
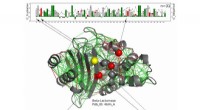 Arbejdsproteiner gør god brug af frustrationI denne strukturelle model for et beta-lactamase-protein, Katalytiske rester er vist som kugler med dem, der konsekvent er stærkt frustrerede langs hele beta-lactamase-familien vist med rødt, og dem,
Arbejdsproteiner gør god brug af frustrationI denne strukturelle model for et beta-lactamase-protein, Katalytiske rester er vist som kugler med dem, der konsekvent er stærkt frustrerede langs hele beta-lactamase-familien vist med rødt, og dem, -
 Reparation og regenerering af perifere nerver mulig med dobbelt polymer hydrogel klæbemiddelVævsteknik samler videnskabelige og medicinske eksperter inden for biomedicinsk teknik, materiale videnskab, molekylær og cellulær biologi, og genteknologi. Kredit:Mary Ann Liebert, Inc., forlag
Reparation og regenerering af perifere nerver mulig med dobbelt polymer hydrogel klæbemiddelVævsteknik samler videnskabelige og medicinske eksperter inden for biomedicinsk teknik, materiale videnskab, molekylær og cellulær biologi, og genteknologi. Kredit:Mary Ann Liebert, Inc., forlag -
 Forskere udvikler ny behandling for knogleinfektion ved hjælp af kobberrigt glasimplantatUndersøgelsens første forfatter Emily Ryan, en nyligt kvalificeret ph.d.-studerende i RCSI Institut for Anatomi, afbilledet med prof Fergal OBrien, Professor i bioingeniør og regenerativ medicin i RCS
Forskere udvikler ny behandling for knogleinfektion ved hjælp af kobberrigt glasimplantatUndersøgelsens første forfatter Emily Ryan, en nyligt kvalificeret ph.d.-studerende i RCSI Institut for Anatomi, afbilledet med prof Fergal OBrien, Professor i bioingeniør og regenerativ medicin i RCS -
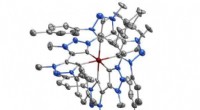 Moderne alkymi skaber selvlysende jernmolekylerKredit:Lunds Universitet En gruppe forskere ved Lunds Universitet i Sverige har lavet det første jernbaserede molekyle, der er i stand til at udsende lys. Dette kunne bidrage til udviklingen af
Moderne alkymi skaber selvlysende jernmolekylerKredit:Lunds Universitet En gruppe forskere ved Lunds Universitet i Sverige har lavet det første jernbaserede molekyle, der er i stand til at udsende lys. Dette kunne bidrage til udviklingen af
- Selvjusteret reaktionsvej muliggør effektiv oxidation af aromatiske CH-bindinger over Co@Y-katalysa…
- Hvordan ville interaktionen mellem atomer og deres elektroner afvige i en kovalent binding?
- To nye krebsdyrarter opdaget på galicisk havbund
- Opdagelse af en ny Hall-effekt:Overtræder den Onsagers gensidige teorem?
- Hvad er mutation.?
- Brug af rangordning til at identificere komplekse genetiske interaktioner


