Beregn atommassen af et element, der indeholder en blandingsisotoper?
Forståelse af isotoper
* isotoper er atomer med det samme element, der har det samme antal protoner, men forskellige antal neutroner. Dette betyder, at de har det samme atomnummer, men forskellige atommasser.
* atommasse: Den gennemsnitlige masse af alle isotoper i et element under hensyntagen til deres relative forekomst.
Beregning af atommasse
1. Identificer isotoperne: Bestem isotoperne, der er til stede i blandingen, og deres respektive masser.
2. Bestem overflod: Find den procentvise overflod (eller fraktioneret overflod) af hver isotop. Dette gives ofte i problemet eller findes i en periodisk tabel.
3. Vægtet gennemsnit: Multiplicer massen af hver isotop med dens overflod (som en decimal), og opsummer derefter resultaterne.
Formel:
Atommasse =(masse af isotop 1 × Overflod af isotop 1) + (masse af isotop 2 × overflod af isotop 2) + ...
eksempel
Lad os sige, at du har et element med to isotoper:
* Isotop 1:Masse =10,01 amu, overflod =90%
* Isotop 2:Masse =11,01 amu, overflod =10%
Beregning:
Atommasse =(10,01 amu × 0,90) + (11,01 amu × 0,10)
Atommasse =9.009 Amu + 1.101 Amu
atommasse =10.11 amu
Vigtig note: Atommasser udtrykkes normalt i atommasseenheder (AMU).
 Varme artikler
Varme artikler
-
 Elektronisk entropi forbedrer vandspaltningKredit:George Hodan/public domain Forskere har længe vidst, at cerium er det bedste element at bruge, når man spalter vand til brint og ilt - en nøgleteknik til at skabe brintgas til brændstof. Me
Elektronisk entropi forbedrer vandspaltningKredit:George Hodan/public domain Forskere har længe vidst, at cerium er det bedste element at bruge, når man spalter vand til brint og ilt - en nøgleteknik til at skabe brintgas til brændstof. Me -
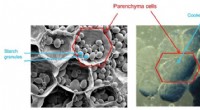 Ny forarbejdningsteknik kan gøre kartofler sundereMikroskopisk billede af kartoffelvæv før (venstre) og efter (højre) kogning eller forarbejdning. Kredit:Amy Lin, A*STAR, og Yijing Shao og YuLian Lin, University of Idaho. Forskere annoncerede tidl
Ny forarbejdningsteknik kan gøre kartofler sundereMikroskopisk billede af kartoffelvæv før (venstre) og efter (højre) kogning eller forarbejdning. Kredit:Amy Lin, A*STAR, og Yijing Shao og YuLian Lin, University of Idaho. Forskere annoncerede tidl -
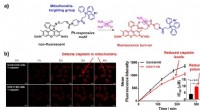 En mitokondri-målrettet fluorescerende sonde til cisplatin(a) Figur viser ændringen i den molekylære struktur af den mitokondri-målrettende sonde Rho-Mito i nærvær af lægemidlet cisplatin mod kræft. Dette får fluorescensen til at tænde, muliggør organelspeci
En mitokondri-målrettet fluorescerende sonde til cisplatin(a) Figur viser ændringen i den molekylære struktur af den mitokondri-målrettende sonde Rho-Mito i nærvær af lægemidlet cisplatin mod kræft. Dette får fluorescensen til at tænde, muliggør organelspeci -
 At få olien ud af tilsmudset vandBillede taget ved hjælp af MIT-forskernes system viser fibrene i filtermembranen i rødt, og de olieagtige dråber, der samler sig på den i grønt. Farverne stammer fra fluorescerende farvestoffer tilsat
At få olien ud af tilsmudset vandBillede taget ved hjælp af MIT-forskernes system viser fibrene i filtermembranen i rødt, og de olieagtige dråber, der samler sig på den i grønt. Farverne stammer fra fluorescerende farvestoffer tilsat
- Hvilken celle er porøs med vand og andre materialer, men stærk nok understøttelsesceller?
- Positive & Negative Effects of LED Lights
- Ny vej til at afbøde klimaændringer og fremme fremskridt med FN's mål for bæredygtig udvikling
- Unikt billede opnået af forskere med højhastighedskamera viser, hvordan lynafledere fungerer
- Amerikanerne valgte borgmestre, der bekymrer sig om klimaforandringer
- Forsker i fremtidens chips


