Hvilke elementer på periodisk tabel gennemgår færrest kemiske reaktioner?
Her er hvorfor:
* Fuld valensskaller: Noble gasser har en fuld ydre skal af elektroner (8 elektroner, bortset fra helium, der har 2). Denne stabile konfiguration gør dem meget ureaktive.
* Høj ioniseringsenergier: Det kræver en masse energi at fjerne et elektron fra et ædelgasatom, hvilket gør dem resistente over for at miste elektroner i kemiske reaktioner.
* Lav elektronaffinitet: Noble gasser har en lav tendens til at få elektroner, da deres stabile konfiguration gør at tilføje en anden elektron ugunstig.
Mens ædle gasser er kendt for deres manglende reaktivitet, kan de stadig deltage i nogle reaktioner under ekstreme forhold, såsom meget høje temperaturer eller tryk.
 Varme artikler
Varme artikler
-
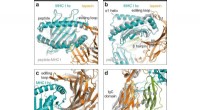 Molekylære chaperoninteraktioner visualiseret gennem røntgenstrukturanalyseKonformationelle ændringer ved klient-chaperone engagement. et topbillede af superpositionering af peptid-receptiv MHC I i chaperonkomplekset (MHC I hc, teal; tapasin, orange) med peptidbundet H2-Db (
Molekylære chaperoninteraktioner visualiseret gennem røntgenstrukturanalyseKonformationelle ændringer ved klient-chaperone engagement. et topbillede af superpositionering af peptid-receptiv MHC I i chaperonkomplekset (MHC I hc, teal; tapasin, orange) med peptidbundet H2-Db ( -
 En grænsedans for amyloid-β, der træder ind i demens(a) Et Aβ-peptid, der danner en β-hårnålestruktur ved den hydrofile/hydrofobe grænseflade. (b) Udsigt fra bunden af panelet (a). Kredit:ExCELLS/IMS Alzheimers sygdom er forårsaget af aggregater
En grænsedans for amyloid-β, der træder ind i demens(a) Et Aβ-peptid, der danner en β-hårnålestruktur ved den hydrofile/hydrofobe grænseflade. (b) Udsigt fra bunden af panelet (a). Kredit:ExCELLS/IMS Alzheimers sygdom er forårsaget af aggregater -
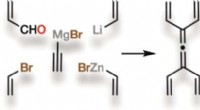 Anstrengt, symmetrisk, og nyt:Tetravinylallen, et lille, men kraftfuldt molekyle, er blevet syntetis…Kredit:Wiley Mange naturlige forbindelser, der bruges i medicin, har komplekse molekylære arkitekturer, som er svære at genskabe i laboratoriet. Hjælp kunne komme fra et lille kulbrintemolekyle, k
Anstrengt, symmetrisk, og nyt:Tetravinylallen, et lille, men kraftfuldt molekyle, er blevet syntetis…Kredit:Wiley Mange naturlige forbindelser, der bruges i medicin, har komplekse molekylære arkitekturer, som er svære at genskabe i laboratoriet. Hjælp kunne komme fra et lille kulbrintemolekyle, k -
 Forskning i brugsklar terapeutisk mad søger drastisk reduktion af dødsfald som følge af alvorlig …MIT kandidatstuderende Tonghan Gu (til højre) arbejder med teknikere på en facilitet i Vasai, Indien, at producere et parti brugsklare terapeutiske fødevarer i pulverform. Formlen, han har udviklet, b
Forskning i brugsklar terapeutisk mad søger drastisk reduktion af dødsfald som følge af alvorlig …MIT kandidatstuderende Tonghan Gu (til højre) arbejder med teknikere på en facilitet i Vasai, Indien, at producere et parti brugsklare terapeutiske fødevarer i pulverform. Formlen, han har udviklet, b


