Hvad ville der ske, hvis gasvolumenet faldt og derefter steg?
faldende volumen
* Trykforøgelse: Når du reducerer volumenet af en gas, mens du holder temperaturen konstant, har gasmolekylerne mindre plads til at bevæge sig rundt. Dette fører til hyppigere kollisioner med containervæggene, hvilket resulterer i en stigning i trykket. Tænk på det som at presse en ballon - luften indeni bliver komprimeret og skubber hårdere mod ballonen.
* densitetsforøgelse: Da den samme mængde gas nu er pakket i et mindre rum, øges gasens densitet. Der er flere gasmolekyler pr. Enhedsvolumen.
stigende volumen
* Trykfald: Når du øger gasens volumen, har molekylerne mere plads til at bevæge sig. Dette fører til færre kollisioner med containervæggene, hvilket resulterer i et fald i tryk. Som at lade luft ud af en ballon falder trykket inde.
* Densitet falder: Når gassen udvides, spredes den samme mængde gas over et større volumen, hvilket gør densiteten lavere.
Nøglepunkter:
* Boyle's lov: Dette forhold mellem volumen og tryk for en gas er beskrevet af Boyle's lov, der siger, at trykket fra en gas er omvendt proportionalt med dens volumen ved konstant temperatur.
* Temperatur: Vi antager, at temperaturen forbliver konstant i dette scenarie. Hvis temperaturen ændres, bliver forholdet mellem volumen og tryk mere kompliceret.
* Eksempel i den virkelige verden: Forestil dig en cykelpumpe. Når du skubber ned på håndtaget, reducerer du mængden af luft indeni, hvilket får presset til at stige, hvilket derefter tvinger luften ind i dækket.
Kortfattet:
At reducere volumenet af en gas øger dens tryk og densitet. Forøgelse af volumenet af en gas reducerer dens tryk og densitet. Dette forhold styres af Boyle's lov og er grundlæggende for at forstå gassens opførsel.
Sidste artikelHvilke diatomiske elementer er gasser ved stuetemperatur?
Næste artikelEr der noget alternativ til Nafion i elektrolyse?
 Varme artikler
Varme artikler
-
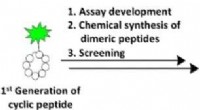 Screening for makrocykliske peptiderKredit:Ganga B. Vamisetti et al. Udviklingen af et fluorescens-baseret kompetitivt assay muliggjorde opdagelsen af dimeriske cykliske peptidmodulatorer af ubiquitinkæder, Angewandte Chemie Intern
Screening for makrocykliske peptiderKredit:Ganga B. Vamisetti et al. Udviklingen af et fluorescens-baseret kompetitivt assay muliggjorde opdagelsen af dimeriske cykliske peptidmodulatorer af ubiquitinkæder, Angewandte Chemie Intern -
 Forskning i perovskit-silicium tandemceller viser ny vej at gåNREL-forskerne Chuanxiao Xiao (til venstre) og Kai Zhu samarbejdede med forskere fra Republikken Korea for at validere potentialet af perovskit-silicium tandem solceller til at opnå mere end 30 % effe
Forskning i perovskit-silicium tandemceller viser ny vej at gåNREL-forskerne Chuanxiao Xiao (til venstre) og Kai Zhu samarbejdede med forskere fra Republikken Korea for at validere potentialet af perovskit-silicium tandem solceller til at opnå mere end 30 % effe -
 SwissFEL gør proteinstrukturer synligeMichael Hennig (til venstre) og Karol Nass på forsøgsstationen i SwissFEL, hvor deres pilotforsøg blev udført. Kredit:Paul Scherrer Institute/Mahir Dzambegovic Til udvikling af nye lægemidler, præ
SwissFEL gør proteinstrukturer synligeMichael Hennig (til venstre) og Karol Nass på forsøgsstationen i SwissFEL, hvor deres pilotforsøg blev udført. Kredit:Paul Scherrer Institute/Mahir Dzambegovic Til udvikling af nye lægemidler, præ -
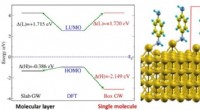 Energiniveaujustering for molekylær elektronik(Venstre) Figur viser elektronenerginiveaujusteringen af benzen-diaminmolekyler på guldoverfladesystemet (vist til højre). Energiniveauerne er vist for et molekylært lag (sort) og for et enkelt mole
Energiniveaujustering for molekylær elektronik(Venstre) Figur viser elektronenerginiveaujusteringen af benzen-diaminmolekyler på guldoverfladesystemet (vist til højre). Energiniveauerne er vist for et molekylært lag (sort) og for et enkelt mole
- Hvad sker der, når sukker røres ud i vand?
- Forskere udvikler nanoporøs super-multi-element katalysator
- Feedback fra tusindvis af designs kunne transformere proteinteknologi
- Glacier-løsninger:En ny fare i en opvarmende verden?
- Floder rasede på Mars sent i dens historie
- Tesla uden moskus ved rattet? Det er, hvad SEC ønsker


