Når der tilsættes almindeligt salt til is end hvad dets smeltepunkt?
Her er hvorfor:
* frysningspunktdepression: Tilsætning af et opløst stof (som salt) til et opløsningsmiddel (som vand) sænker opløsningens frysepunkt. Dette er en kolligativ egenskab, hvilket betyder, at det afhænger af koncentrationen af opløst stof, ikke dens identitet.
* forstyrrelse af krystalgitter: Salt opløses i vand og danner ioner. Disse ioner forstyrrer den almindelige krystalgitterstruktur af is, hvilket gør det sværere for vandmolekyler at danne fast is. Dette fører til et lavere frysepunkt.
Praktisk eksempel: Dette er grunden til, at salt bruges til at smelte is på veje og fortove om vinteren. Salt sænker vandets frysepunkt og forhindrer, at isen danner eller smelter eksisterende is.
Sidste artikelHvad er smeltepunktet for en is i 0 grader c?
Næste artikelHvilke genstande bremser smeltningen af is?
 Varme artikler
Varme artikler
-
 Reduktion muliggør renere og mere effektive katalytiske reaktionerKredit:Tokyo Institute of Technology I et løbende forsøg på at fremskynde katalytiske reaktioner, oxidation af metalkomplekser ved hjælp af lys er dukket op som en standardmetode til at syntetiser
Reduktion muliggør renere og mere effektive katalytiske reaktionerKredit:Tokyo Institute of Technology I et løbende forsøg på at fremskynde katalytiske reaktioner, oxidation af metalkomplekser ved hjælp af lys er dukket op som en standardmetode til at syntetiser -
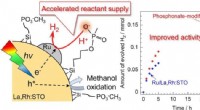 Øget fotokatalyse for hydrogenudvikling:Reaktantforsyning gennem phosphonatgrupperSkematisk illustration af alkylsilanphosphonatmodifikationen af en Ru/La, Rh:STO fotokatalysator for at fremskynde reaktantforsyningen. Kredit:© 2020 Yosuke Kageshima, Shinshu universitet Forskn
Øget fotokatalyse for hydrogenudvikling:Reaktantforsyning gennem phosphonatgrupperSkematisk illustration af alkylsilanphosphonatmodifikationen af en Ru/La, Rh:STO fotokatalysator for at fremskynde reaktantforsyningen. Kredit:© 2020 Yosuke Kageshima, Shinshu universitet Forskn -
 Innovativ forarbejdning og emballering for sikker, høj kvalitet, økologiske bærprodukterKredit:Stanislav Samoylik, Shutterstock I løbet af de sidste to årtier, der har været stigende bekymring for de negative virkninger af konventionelt dyrkede produkter på vores sundhed og miljøet.
Innovativ forarbejdning og emballering for sikker, høj kvalitet, økologiske bærprodukterKredit:Stanislav Samoylik, Shutterstock I løbet af de sidste to årtier, der har været stigende bekymring for de negative virkninger af konventionelt dyrkede produkter på vores sundhed og miljøet. -
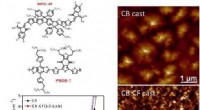 Binær opløsningsmiddelblanding, der øger høj effektivitet af polymersolcellerDe kemiske strukturer af elektrondonor PBDB-T og fluoreret NFA INPIC-4F; J-V karakteristika for PBDB-T:INPIC-4F solceller støbt af forskellige opløsningsmidler; AFM-billederne af PBDB-T:INPIC-4F overf
Binær opløsningsmiddelblanding, der øger høj effektivitet af polymersolcellerDe kemiske strukturer af elektrondonor PBDB-T og fluoreret NFA INPIC-4F; J-V karakteristika for PBDB-T:INPIC-4F solceller støbt af forskellige opløsningsmidler; AFM-billederne af PBDB-T:INPIC-4F overf
- Hvilken gruppe indeholder otte valenselektroner?
- Hvordan organisationer kan booste velgørende gaver
- Igneous klipper danner forskelligt forskellige steder.?
- Sådan producerer stressede planter deres egen aspirin
- Hvorfor er vinden en bedre spredning for sporer end frø?
- Hvorfor skifter alkylhalogenidlag fra top til bund på det punkt, hvor vand bruges ekstrakt organisk…


