Hvordan opdeles ammoniumchlorid med vandfordampning?
1. Opløsning i vand: Når ammoniumchlorid opløses i vand, adskiller det sig i dets ioner:
`` `
NH₄CL (S) -> NH₄⁺ (AQ) + CL⁻ (AQ)
`` `
Ammoniumionerne (NH₄⁺) og chloridioner (CL⁻) bliver omgivet af vandmolekyler og danner hydratiserede ioner.
2. Vandfordampning: Når vand fordamper, falder koncentrationen af vandmolekyler. Dette forstyrrer balancen mellem de hydratiserede ioner og det omgivende vand.
3. Krystallisation: For at opretholde ligevægt rekombineres nogle af ammonium- og chloridioner og danner faste ammoniumchloridkrystaller.
I det væsentlige fjerner fordampningen af vand det opløsningsmiddel, der holdt ammoniumchloridioner adskilt. Dette tvinger dem sammen igen, hvilket fører til dannelse af fast ammoniumchlorid.
Det er vigtigt at bemærke:
* Ammoniumchlorid er et opløseligt Salt, hvilket betyder, at det let opløses i vand.
* Den ovenfor beskrevne proces er reversibel . Hvis du tilsætter mere vand til det faste ammoniumchlorid, opløses det igen.
Fortæl mig, hvis du har andre spørgsmål.
Sidste artikelHvilken forbindelse har en nitrogen og tre hydrogener?
Næste artikelHvad er anvendelsen af plastpulverbelægning?
 Varme artikler
Varme artikler
-
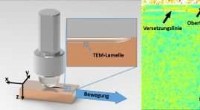 Materialeforskere studerer årsagerne til slid - permanente molekylære modifikationer opstår ved f…Når safirkuglen bevæger sig hen over kobberprøven, materialet ændres permanent. Kredit:Paul Schreiber, SÆT/IAM Slid har stor indflydelse på økonomisk effektivitet og sundhed. Alle bevægelige dele
Materialeforskere studerer årsagerne til slid - permanente molekylære modifikationer opstår ved f…Når safirkuglen bevæger sig hen over kobberprøven, materialet ændres permanent. Kredit:Paul Schreiber, SÆT/IAM Slid har stor indflydelse på økonomisk effektivitet og sundhed. Alle bevægelige dele -
 Ny højhastighedstest viser, hvordan antibiotika kombineres for at dræbe bakterierMed den modificerede agarplade CombiANT er det muligt at lave højhastighedstests for at se, hvordan bakterier reagerer på forskellige kombinationer af antibiotika. Kredit:Nikos Fatsis-Kavalopoulos
Ny højhastighedstest viser, hvordan antibiotika kombineres for at dræbe bakterierMed den modificerede agarplade CombiANT er det muligt at lave højhastighedstests for at se, hvordan bakterier reagerer på forskellige kombinationer af antibiotika. Kredit:Nikos Fatsis-Kavalopoulos -
 For en lav-kulstof cement opskrift, videnskabsmænd kigger på jordens gryderScanning Electron Microscope billede af den cementholdige matrix af en brudsten. Cement betragtes som et net af sammenflettede fibre, når det afbildes i nanoskala. Kredit:Udlånt af Shalev Siman-Sov, S
For en lav-kulstof cement opskrift, videnskabsmænd kigger på jordens gryderScanning Electron Microscope billede af den cementholdige matrix af en brudsten. Cement betragtes som et net af sammenflettede fibre, når det afbildes i nanoskala. Kredit:Udlånt af Shalev Siman-Sov, S -
 Ny katalysator hjælper med at omdanne kuldioxid til brændstofAisulu Aitbekova, venstre, og Matteo Cargnello foran reaktoren, hvor Aitbekova udførte mange af eksperimenterne til dette projekt. Kredit:L.A. Cicero Forestil dig at få fat i kuldioxid fra bilers
Ny katalysator hjælper med at omdanne kuldioxid til brændstofAisulu Aitbekova, venstre, og Matteo Cargnello foran reaktoren, hvor Aitbekova udførte mange af eksperimenterne til dette projekt. Kredit:L.A. Cicero Forestil dig at få fat i kuldioxid fra bilers
- Brug af fortiden til at optrevle fremtiden for arktiske vådområder
- Gen Zers og millennials er stadig store fans af bøger - selvom de ikke kalder sig læsere
- Skiftende dimensioner:Spændende excitoner i phosphoren
- Risici og afvejninger ved at leje fra en privat udlejer
- NASA forbereder sig på Artemis I-tankingtest for skud til afsendelse i næste uge
- Computersimuleringer viser, at vikingernes solsten er meget nøjagtige


