Hvad er en reaktiv ikke -metal?
ikke -metaller er generelt mere reaktive end metaller Fordi de har en tendens til at få elektroner for at opnå en stabil elektronkonfiguration. Dette betyder, at de let danner bindinger med andre elementer, især metaller.
Eksempler på meget reaktive ikke -metaller:
* halogener (gruppe 17): Fluor (F), chlor (CL), brom (BR), jod (I) og astatine (AT) er utroligt reaktive. De danner let ioniske forbindelser med metaller og reagerer eksplosivt med mange stoffer. Fluor er den mest reaktive ikke -metale.
* ilt (O): Vigtigt for livet, ilt er meget reaktiv og understøtter forbrænding. Det kombineres let med mange elementer.
* nitrogen (n): Selvom det er mindre reaktivt end ilt, kan nitrogen danne stærke bindinger og er afgørende i dannelsen af forskellige forbindelser.
mindre reaktive ikke -metaller:
* ædle gasser (gruppe 18): Helium (He), Neon (NE), Argon (AR), Krypton (KR), Xenon (XE) og Radon (RN) er meget ureaktive på grund af deres fulde elektronskaller. De omtales ofte som "inerte gasser."
* carbon (c): Carbon er et fascinerende element, fordi det kan danne flere bindinger med sig selv og andre elementer. Det er ikke så reaktivt som halogener eller ilt, men kan være ret reaktive under visse betingelser.
Vigtige noter:
* reaktivitet påvirkes af faktorer: Temperatur, tryk og tilstedeværelsen af andre elementer kan påvirke reaktiviteten af en ikke -metal.
* reaktivitet er et spektrum: Ikke -metaller falder ikke i pæne kategorier af "reaktive" eller "ureaktive." Det er mere nøjagtigt at beskrive deres relative reaktivitet sammenlignet med andre elementer.
Fortæl mig, hvis du gerne vil have mig til at uddybe specifikke eksempler på ikke -metalreaktioner, eller hvordan reaktivitet påvirkes af forskellige forhold!
Sidste artikelKan heliumatom lide at b e af sig selv?
Næste artikelHvorfor er halogenerne så reaktive og ædle gasser ikke reaktive?
 Varme artikler
Varme artikler
-
 Et spil pool i den levende celleIllustration af den nye kemo-optogenetiske metode præsenteret af forskergruppen af Yaowen Wu Kredit:Yaowen Wu, Umeå Universitet Celler skal reagere på miljøændringer og opretholde et afbalancere
Et spil pool i den levende celleIllustration af den nye kemo-optogenetiske metode præsenteret af forskergruppen af Yaowen Wu Kredit:Yaowen Wu, Umeå Universitet Celler skal reagere på miljøændringer og opretholde et afbalancere -
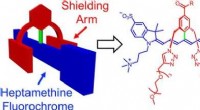 Stabile og funktionelle farvestoffer til nær-infrarød fluorescensbilleddannelse af levende individ…Kredit:Wiley Forskere kan overvåge biomolekylære processer i levende væv ved hjælp af ikke-invasive optiske metoder, såsom fluorescensbilleddannelse. Imidlertid, de fluorescerende farvestoffer, de
Stabile og funktionelle farvestoffer til nær-infrarød fluorescensbilleddannelse af levende individ…Kredit:Wiley Forskere kan overvåge biomolekylære processer i levende væv ved hjælp af ikke-invasive optiske metoder, såsom fluorescensbilleddannelse. Imidlertid, de fluorescerende farvestoffer, de -
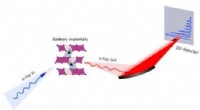 Overbygningens rolle i førstegangsspændingstab i lithium-ion-batterierFigur 1. Den typiske konfiguration af et RIXS-eksperiment. Indkommende røntgenstråler med høj energiopløsning skinner på prøverne, og de spredte røntgenstråler opløses i energi og bliver opsamlet af e
Overbygningens rolle i førstegangsspændingstab i lithium-ion-batterierFigur 1. Den typiske konfiguration af et RIXS-eksperiment. Indkommende røntgenstråler med høj energiopløsning skinner på prøverne, og de spredte røntgenstråler opløses i energi og bliver opsamlet af e -
 Maskinlæring kunne lære os, hvordan man gør fremstilling af materialer renere og mere bæredygtigMaskinlæring og design af eksperimenter kan kombineres for at identificere den mest bæredygtige metode til udvikling af avancerede materialer. Kredit:020 KAUST; Xavier Pita Kemi computeralgoritme
Maskinlæring kunne lære os, hvordan man gør fremstilling af materialer renere og mere bæredygtigMaskinlæring og design af eksperimenter kan kombineres for at identificere den mest bæredygtige metode til udvikling af avancerede materialer. Kredit:020 KAUST; Xavier Pita Kemi computeralgoritme
- Hvad består livsstøtteudstyr af?
- Tang kan blive en rentabel brik i den grønne overgangsstiksav
- Dødeligt våben:Ny antimikrobiel belægning kan revolutionere rengøringsmetoder
- Ny 3-D bioprintingsplatform til mikroplader til konstruktion af muskel- og senevæv
- Zuckerberg forsvarer Facebook i ny kontradiktion om brud på data
- Forbedring af påvisningen af antistoffer mod afrikansk svinepestvirus i serum


