Hvad gør vandopløsningsmiddel?
Polaritet:
* Vandmolekyler er bøjet, hvor iltatomet er lidt negative, og brintatomerne er lidt positive.
* Denne ujævne fordeling af ladning skaber et dipolmoment, hvilket gør vand til et polært molekyle.
* Polære molekyler som vand tiltrækkes af andre polære molekyler eller ioner, så de kan opløses.
Hydrogenbinding:
* De lidt positive hydrogenatomer i et vandmolekyle kan danne svage bindinger kaldet hydrogenbindinger med de lidt negative iltatomer i et andet vandmolekyle.
* Denne stærke intermolekylære kraft hjælper med at holde vandmolekyler sammen og skabe et sammenhængende netværk.
* Når et polært stof som salt (NaCl) tilsættes til vand, tiltrækkes de positive natriumioner (Na+) af de negative iltatomer i vand, og de negative chloridioner (Cl-) tiltrækkes af de positive hydrogenatomer i vand.
* Denne attraktion bryder de ioniske bindinger fra hinanden, der holder saltet sammen, så ionerne kan opløses i vandet.
Kortfattet:
* Den polære natur af vand giver den mulighed for at interagere med og opløse andre polære molekyler og ioner.
* De stærke hydrogenbindinger mellem vandmolekyler forbedrer dens solvationsevne yderligere.
Dette er grunden til, at vand ofte omtales som det "universelle opløsningsmiddel", selvom det ikke opløser alt!
Sidste artikelHvad er der lavet af jern?
Næste artikelHvad er en organisk plast?
 Varme artikler
Varme artikler
-
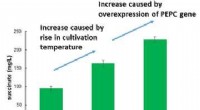 Verdens mest effektive produktion af succinat fra kuldioxidFigur 1:Øgede mængder succinat produceres baseret på overekspression af PEPC -gener og forhøjelse af dyrkningstemperaturen. Kredit:Kobe University Succinat bruges i vid udstrækning som en rå ingre
Verdens mest effektive produktion af succinat fra kuldioxidFigur 1:Øgede mængder succinat produceres baseret på overekspression af PEPC -gener og forhøjelse af dyrkningstemperaturen. Kredit:Kobe University Succinat bruges i vid udstrækning som en rå ingre -
 Ny katalysator overstråler platin til fremstilling af brintKredit:CC0 Public Domain Brint, det mest udbredte element i universet, giver et stærkt slag. Og fordi det ikke indeholder kulstof, det producerer kun vand, når det bruges som brændstof. Men på jor
Ny katalysator overstråler platin til fremstilling af brintKredit:CC0 Public Domain Brint, det mest udbredte element i universet, giver et stærkt slag. Og fordi det ikke indeholder kulstof, det producerer kun vand, når det bruges som brændstof. Men på jor -
 Håndholdt enhed kan kontrollere, om fiskeolietilskud er udløbetKredit:Plante- og fødevareforskning Fiskeoliekapsler er et populært sundhedstilskud med mange sundhedsmæssige fordele, men der er rejst bekymring over kvaliteten, fordi omega-3 fedtsyrer er meget
Håndholdt enhed kan kontrollere, om fiskeolietilskud er udløbetKredit:Plante- og fødevareforskning Fiskeoliekapsler er et populært sundhedstilskud med mange sundhedsmæssige fordele, men der er rejst bekymring over kvaliteten, fordi omega-3 fedtsyrer er meget -
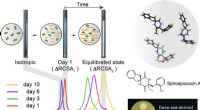 Bestemmelse af atomstrukturen af naturlige produkter hurtigere og mere præcistMåling af den resterende kemiske skiftanisotropi i et flydende krystallinsk medium. Metoden blev brugt til at bestemme stereokemien af spiroepicoccin A, et nyligt opdaget naturprodukt. Det nye natur
Bestemmelse af atomstrukturen af naturlige produkter hurtigere og mere præcistMåling af den resterende kemiske skiftanisotropi i et flydende krystallinsk medium. Metoden blev brugt til at bestemme stereokemien af spiroepicoccin A, et nyligt opdaget naturprodukt. Det nye natur
- Hvor mange gram CO2 bruges, når 8,0 g O2 produceres?
- Tidsmaskinesimuleringer oprettet for at studere livscyklussen for forfædre galaksehobe
- Hvordan bakterier skaber en sparegris til de magre tider
- Dødsfaldige storme i Indien dræber næsten 150
- Hvad er pH for et surt smagende stof?
- Kontrolleret, hvordan detonationer virker


