Hvordan giver en ædel gas et ikke -reaktivt miljø?
1. Elektronkonfiguration:
* Atomer stræber efter at opnå en stabil elektronkonfiguration, der ligner den nærmeste ædle gas. Dette betyder at have en fuld ydre skal af elektroner.
* Ædle gasser har allerede en fuld ydre skal. For eksempel har Helium (HE) 2 elektroner, der fylder sine 1s orbital. Neon (NE) har 10 elektroner, der fylder sine 2s og 2p orbitaler.
2. Reaktivitet og oktetreglen:
* Atomer har en tendens til at vinde, miste eller dele elektroner for at opnå en fuld ydre skal efter oktetreglen (undtagen helium, der har en fuld skal med 2 elektroner).
* Da ædle gasser allerede har en fuld ydre skal, behøver de ikke at vinde, miste eller dele elektroner for at blive stabile. Dette gør dem utroligt ureaktive.
3. Ikke -reaktive miljøer:
* Når en ædel gas er til stede, giver den et ikke -reaktivt miljø, fordi den ikke let deltager i kemiske reaktioner.
* Dette gør dem ideelle til applikationer, hvor reaktivitet skal minimeres, såsom:
* konservering: Opbevaring af stærkt reaktive stoffer som alkalimetaller.
* belysning: Påfyldning af lyspærer for at forhindre filamentoxidation (f.eks. Argon).
* svejsning: Oprettelse af en inert atmosfære til svejsning (f.eks. Argon).
* Medicinsk billeddannelse: MR -maskiner bruger ofte helium som kølemiddel.
Kortfattet: Den fulde ydre skal af elektroner i ædle gasatomer gør dem ekstremt stabile og resistente over for kemiske reaktioner. Denne ikke -reaktive karakter giver et beskyttende miljø for andre stoffer.
Sidste artikelHvilket kemisk element findes i glukose?
Næste artikelHvorfor kaldes olie et hydrofobt stof?
 Varme artikler
Varme artikler
-
 Nyt materiale baner vejen for fjernstyret medicin og elektroniske pillerPolymeroverfladen, der ses som børster på billedet, reagerer på en elektrisk puls ved at skifte tilstand fra at fange til at frigive de grønne biomolekyler. Polymeroverfladen fanger først biomolekyler
Nyt materiale baner vejen for fjernstyret medicin og elektroniske pillerPolymeroverfladen, der ses som børster på billedet, reagerer på en elektrisk puls ved at skifte tilstand fra at fange til at frigive de grønne biomolekyler. Polymeroverfladen fanger først biomolekyler -
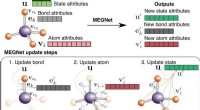 Ingeniører bruger grafnetværk til nøjagtigt at forudsige egenskaber af molekyler og krystallerSkematisk illustration af MEGNet-modeller. Kredit:Chi Chen/Materials Virtual Lab Nanoingeniører ved University of California San Diego har udviklet nye deep learning-modeller, der præcist kan foru
Ingeniører bruger grafnetværk til nøjagtigt at forudsige egenskaber af molekyler og krystallerSkematisk illustration af MEGNet-modeller. Kredit:Chi Chen/Materials Virtual Lab Nanoingeniører ved University of California San Diego har udviklet nye deep learning-modeller, der præcist kan foru -
 Video:Kan du fejle en lægemiddeltest ved at tage CBD?Kredit:The American Chemical Society Cannabidiol, eller CBD, er en ikke-psykoaktiv forbindelse produceret af marihuanaplanten, der synes at være overalt i disse dage. Måske er du endda blevet spur
Video:Kan du fejle en lægemiddeltest ved at tage CBD?Kredit:The American Chemical Society Cannabidiol, eller CBD, er en ikke-psykoaktiv forbindelse produceret af marihuanaplanten, der synes at være overalt i disse dage. Måske er du endda blevet spur -
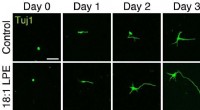 Oleoyl-LPE udøver neuritstimulering og neurobeskyttelseNeuritforlængelse, der fremmer handling Kredit:2021, Hisano et al., Shinshu universitet Lysophospholipider er fosfolipider, der kun har én fedtsyrekæde, og i de senere år, lysophospholipiders roll
Oleoyl-LPE udøver neuritstimulering og neurobeskyttelseNeuritforlængelse, der fremmer handling Kredit:2021, Hisano et al., Shinshu universitet Lysophospholipider er fosfolipider, der kun har én fedtsyrekæde, og i de senere år, lysophospholipiders roll
- Pensioneret MR -scanner får nyt liv ved at studere stjernerne
- Google er stadig under beskydning på grund af EU's antitrust-overtrædelser
- Hvad er din reaktion på termisk energi?
- Går med strømmen:hvordan fækale bakterier spredes i vandløb
- Alger og krill kan være et hårdt salg for europæiske forbrugere
- Crossover fra 2-D metal til 3-D Dirac semimetal i metalliske PtTe2-film med lokal Rashba-effekt


