Hvordan reagerer Diamond med luft?
* Stærke kulstofobligationer: Diamanter er lavet af rene carbonatomer arrangeret i en meget stærk, tæt bundet krystalgitter. Dette gør diamanten meget stabil og modstandsdygtig over for kemisk angreb.
* Manglende reaktivitet: Carbonatomerne i en diamant er allerede fuldt bundet og har ingen løse elektroner til at deltage i kemiske reaktioner.
* Høj oxidationstemperatur: Mens diamanter kan oxideres (brænder) ved ekstremt høje temperaturer (ca. 800 ° C i rent ilt), er dette ikke noget, der sker i typisk luft.
Der er dog nogle undtagelser:
* Meget høje temperaturer: Ved ekstremt høje temperaturer (som dem, der findes i en brand eller en ovn), kan diamant reagere med ilt i luften for at danne kuldioxid. Dette er forbrændingsprocessen.
* urenheder: Diamanter, der indeholder urenheder, som nitrogen eller bor, kan blive mindre stabile og kan reagere lettere med luft ved høje temperaturer.
* Specialiserede betingelser: I laboratorieindstillinger kan forskere bruge specifikke kemikalier og forhold til kemisk at ændre eller ætses overfladen af en diamant.
Kortfattet: Under normale omstændigheder er diamanter ekstremt stabile og reagerer ikke med luft. De er resistente over for oxidation og forbliver kemisk inerte.
 Varme artikler
Varme artikler
-
 Ingeniører kan opdage ultra sjældne proteiner i blodet ved hjælp af et mobiltelefonkameraForskernes detektionssystem bruger et standard mobiltelefonkamera til at optage video af mikrodråber, når de passerer linsen. Fluorescerende markører kan identificeres individuelt ved at matche dem me
Ingeniører kan opdage ultra sjældne proteiner i blodet ved hjælp af et mobiltelefonkameraForskernes detektionssystem bruger et standard mobiltelefonkamera til at optage video af mikrodråber, når de passerer linsen. Fluorescerende markører kan identificeres individuelt ved at matche dem me -
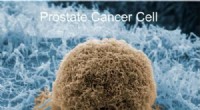 Billig detektor er som velcro til kræftcellerKredit:American Chemical Society Forskere har udviklet en ny type sensor, der fungerer som velcro for prostatacancerceller, klæbe dem på et modificeret matglas, som dem, der bruges i naturfag, så
Billig detektor er som velcro til kræftcellerKredit:American Chemical Society Forskere har udviklet en ny type sensor, der fungerer som velcro for prostatacancerceller, klæbe dem på et modificeret matglas, som dem, der bruges i naturfag, så -
 Oprydning af olieudslipOlie i vand. Kredit:Stock billede, via Carnegie Mellon University, Institut for Kemiteknik Efter tusindvis af liter olie hældt ud i Stillehavet efter udslippet den 2. oktober, agenturer og frivill
Oprydning af olieudslipOlie i vand. Kredit:Stock billede, via Carnegie Mellon University, Institut for Kemiteknik Efter tusindvis af liter olie hældt ud i Stillehavet efter udslippet den 2. oktober, agenturer og frivill -
 Ny leveringsmetode tillader langsom frigivelse af en bredere vifte af peptidlægemidler i kroppenScanning elektronmikrografer billeder af PLGA mikrosfærer. Repræsentative mikrofotografier af (a) blanke PLGA-mikrosfærer og (b) de tomme mikrosfærer fjernbelastet med octreotid (n = 2 uafhængige eksp
Ny leveringsmetode tillader langsom frigivelse af en bredere vifte af peptidlægemidler i kroppenScanning elektronmikrografer billeder af PLGA mikrosfærer. Repræsentative mikrofotografier af (a) blanke PLGA-mikrosfærer og (b) de tomme mikrosfærer fjernbelastet med octreotid (n = 2 uafhængige eksp
- 3-D printede dæk og sko, der reparerer sig selv
- Hvad er forskellen mellem Sasquatch og Bigfoot?
- NASA udvælger undersøgelser for første mission for at støde på solen
- Google tunes-søgning efter forudvidenhed og billeder
- Hvordan multipliceres bakterier?
- Forurening af landbrugsinsekticider truer USA's overfladevandsintegritet på nationalt plan


