Hvordan kombineres carbonatomer, når man danner molekyler, såsom glukose eller fedtsyrer?
1. Kovalent binding:
Carbon har fire elektroner i sin yderste skal, og det har brug for otte for at opnå stabilitet. For at opnå dette deler Carbon sine elektroner med andre atomer gennem kovalente bindinger. Dette betyder, at to atomer deler et par elektroner og danner en stærk binding.
2. Kæder og ringe:
Carbon kan danne enkelt-, dobbelt- eller tredobbeltbindinger med andre carbonatomer, hvilket fører til lange kæder eller endda cykliske strukturer. Dette muliggør en enorm mangfoldighed af kulstofbaserede molekyler.
3. Deltagelse med andre elementer:
Carbon kan binde med forskellige andre elementer, herunder brint, ilt, nitrogen, fosfor og svovl. Disse elementer bidrager til de unikke egenskaber ved forskellige organiske molekyler.
4. Bygning af glukose:
Glukose, et simpelt sukker, har en molekylær formel af C 6 H 12 O 6 . Carbonatomer danner molekylets seks-carbon-rygrad. Hvert carbonatom danner fire kovalente bindinger, der forbinder til andre carbonatomer, hydrogenatomer og iltatomer. Arrangementet af disse bindinger skaber en ringstruktur, der er karakteristisk for sukker.
5. Bygning af fedtsyrer:
Fedtsyrer er lange kæder af carbonatomer forbundet med enkeltbindinger. Hvert carbonatom er bundet til hydrogenatomer, med undtagelse af terminalcarbon, der er bundet til en carboxylgruppe (-COOH). Længden og mætning (antal dobbeltbindinger) af fedtsyrekæden påvirker dens egenskaber.
Kortfattet:
Carbons evne til at danne fire kovalente bindinger, dens evne til at binde sig med sig selv, og dets tilknytning til andre elementer gør det muligt for det at danne et bredt udvalg af molekyler med unikke egenskaber. Dette gør kulstof til livets fundament, hvilket muliggør konstruktion af komplekse strukturer som kulhydrater og fedt.
Sidste artikelHvad er en termokemisk reaktion?
Næste artikelPåvirker en katalysator entalpi af reaktion?
 Varme artikler
Varme artikler
-
 Forbindelse fra lægeurt dræber hjerneædende amøber i laboratorieundersøgelserBlade fra Inula viscosa , en flerårig middelhavsbusk, indeholder en forbindelse, der dræber hjerneædende amøber. Kredit:Tilpasset fra ACS Chemical Neuroscience 2020, DOI:10.1021/acschemneuro.0c006
Forbindelse fra lægeurt dræber hjerneædende amøber i laboratorieundersøgelserBlade fra Inula viscosa , en flerårig middelhavsbusk, indeholder en forbindelse, der dræber hjerneædende amøber. Kredit:Tilpasset fra ACS Chemical Neuroscience 2020, DOI:10.1021/acschemneuro.0c006 -
 Blodprøvegennembrud gode nyheder for gravide kvinderDr. Marnie Winter. Kredit:University of South Australia En bred vifte af føtale genetiske abnormiteter kunne snart opdages tidligt i graviditeten takket være en verdensførste undersøgelse ledet af
Blodprøvegennembrud gode nyheder for gravide kvinderDr. Marnie Winter. Kredit:University of South Australia En bred vifte af føtale genetiske abnormiteter kunne snart opdages tidligt i graviditeten takket være en verdensførste undersøgelse ledet af -
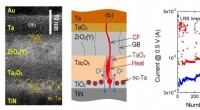 En optimeret struktur af memristiv enhed til neuromorfe computersystemerHøjopløselig transmissionselektronmikroskopibillede (a) og skematisk (b) af tværsnittet af flerlags memristive strukturen i området for den ledende filament (CF), afhængigheden af resistive tilstand
En optimeret struktur af memristiv enhed til neuromorfe computersystemerHøjopløselig transmissionselektronmikroskopibillede (a) og skematisk (b) af tværsnittet af flerlags memristive strukturen i området for den ledende filament (CF), afhængigheden af resistive tilstand -
 Højhastighedsfilm hjælper videnskabsmænd, der designer glødende molekylerAequorea victoria, også kaldet krystalgeléen, er en selvlysende vandmand, der lever nær Stillehavskysten i Nordamerika. Kredit:Gary Kavanagh/iStockphoto.com Krystalvandmændene svømmer ud for Still
Højhastighedsfilm hjælper videnskabsmænd, der designer glødende molekylerAequorea victoria, også kaldet krystalgeléen, er en selvlysende vandmand, der lever nær Stillehavskysten i Nordamerika. Kredit:Gary Kavanagh/iStockphoto.com Krystalvandmændene svømmer ud for Still
- Hvad er de tre typer af gravitationsbevægelser?
- Hvordan en telenovela blev tilpasset til amerikanske publikummer:Med mere sex, vold og alkohol
- Gener viser én stor europæisk familie
- USA forsvarer tiltag til at tilbageføre regler for netneutralitet
- Hvor er alkali-jord-metaller placeret på den periodiske tabel?
- Hvor finder du en watt?


