Hvordan gælder loven om samtalemasse for kemiske reaktioner?
1. Atomer omarrangeres, ødelægges ikke:
- Kemiske reaktioner involverer brud og dannelse af kemiske bindinger mellem atomer.
- Atomerne selv forbliver uændrede. De omarrangerer simpelthen for at danne nye molekyler.
2. Den samlede masse forbliver konstant:
- Den samlede masse af reaktanterne (udgangsmaterialer) skal svare til den samlede masse af produkterne (stoffer dannet).
- Dette skyldes, at antallet og typer atomer, der er til stede, før reaktionen skal svare til antallet og typer af atomer, der er til stede efter reaktionen.
3. Afbalancering af kemiske ligninger:
- Kemiske ligninger repræsenterer den symbolske repræsentation af kemiske reaktioner.
- Loven om bevarelse af masse bruges til at sikre, at antallet af hver type atom på reaktantsiden er lig med antallet af hver type atom på produktsiden. Denne proces kaldes afbalancering af ligningen.
Eksempel:
Reaktionen af brintgas (H2) med iltgas (O2) til at producere vand (H2O):
2 H2 + O2 → 2 H2O
- Reaktanter:4 hydrogenatomer (2 x 2) og 2 iltatomer (1 x 2).
- Produkter:4 hydrogenatomer (2 x 2) og 2 iltatomer (1 x 2).
Som du kan se, er antallet af hver type atom det samme på begge sider af ligningen, hvilket demonstrerer bevarelse af masse.
implikationer for kemi:
* Forudsigelse af produktudbytte: Loven om bevarelse af masse hjælper med at forudsige mængden af produkt, der forventes fra en given mængde reaktanter.
* Forståelse af støkiometri: Støkiometri, studiet af de kvantitative forhold mellem reaktanter og produkter, er meget afhængig af bevarelse af masse.
* Udvikling af kemiske processer: At forstå, hvordan masse er konserveret i reaktioner, er vigtig for at designe og optimere kemiske processer i forskellige brancher.
Undtagelser:
Loven om bevarelse af masse gælder for de fleste almindelige kemiske reaktioner. Det gælder dog ikke for nukleare reaktioner, hvor masse kan omdannes til energi (som beskrevet af Einsteins berømte ligning E =MC²).
 Varme artikler
Varme artikler
-
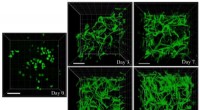 Biopolymerer til sårbehandling leverer stamceller for at forbedre helingenFigur viser det celleledende miljø af gellangummi-kollagen IPN-hydrogeler. De indkapslede fedtafledte mesenkymale stamceller (ADSCer) udviser gradvis tilbagevenden af morfologi til deres sædvanlige
Biopolymerer til sårbehandling leverer stamceller for at forbedre helingenFigur viser det celleledende miljø af gellangummi-kollagen IPN-hydrogeler. De indkapslede fedtafledte mesenkymale stamceller (ADSCer) udviser gradvis tilbagevenden af morfologi til deres sædvanlige -
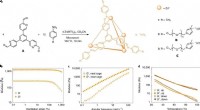 Porøs væske rummer større molekylerForberedelse og reologi af bure 1-3. Kredit: Naturkemi (2020). DOI:10.1038/s41557-020-0419-2 Et internationalt team af kemikere har udviklet en metode til at skabe en ionisk væske, porøs, tetraed
Porøs væske rummer større molekylerForberedelse og reologi af bure 1-3. Kredit: Naturkemi (2020). DOI:10.1038/s41557-020-0419-2 Et internationalt team af kemikere har udviklet en metode til at skabe en ionisk væske, porøs, tetraed -
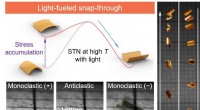 Molekylær switch muliggør fotomekanisk spring af polymererDen foto-inducerede bi-stabile struktur gør det muligt for den fotoaktive flydende krystallinske polymer at opnå snap-through inspireret spring. Effektiv fotoinduceret energiakkumulering og frigivelse
Molekylær switch muliggør fotomekanisk spring af polymererDen foto-inducerede bi-stabile struktur gør det muligt for den fotoaktive flydende krystallinske polymer at opnå snap-through inspireret spring. Effektiv fotoinduceret energiakkumulering og frigivelse -
 Lavt kalorieindhold sødemiddel afledt af lactose får fremstillingsfremgang fra gærForskerne tilføjede gener, der leder gærens eget stofskifte til at producere tagatose. På billedet, fra venstre:University of California, Berkeley -professor Jamie Cate, Illinois postdoktor Jingjing L
Lavt kalorieindhold sødemiddel afledt af lactose får fremstillingsfremgang fra gærForskerne tilføjede gener, der leder gærens eget stofskifte til at producere tagatose. På billedet, fra venstre:University of California, Berkeley -professor Jamie Cate, Illinois postdoktor Jingjing L
- Astronauter fra NASAs ekspedition 71 for at udføre forskning ombord på rumstationen
- Forskere bruger infrarødt lys til trådløst at overføre strøm over 30 meter
- Ny teknik til at automatisere produktionen af farmaceutiske forbindelser
- Udvidelse af usikkerhedsprincippet ved at bruge en ubegrænset operator
- En kemisk funktionel fosforversion af naturgummi
- Nanoelektronik kunne få et løft fra kulstofforskning


