Hvor finder du elementer grupperet, der har de mest lignende fysiske og kemiske egenskaber?
Specifikt er de grupperet inden for den samme lodret kolonne , som kaldes en gruppe eller familie .
For eksempel:
* gruppe 1 (alkalimetaller): Lithium (Li), natrium (NA), kalium (K), rubidium (RB), cæsium (CS) og francium (FR) er alle bløde, meget reaktive metaller, der let mister en elektron til dannelse af en +1 ion.
* gruppe 17 (halogener): Fluor (F), chlor (CL), brom (BR), jod (I) og astatin (AT) er alle ikke -metaller, der let får en elektron til dannelse af en -1 -ion. De er alle meget reaktive og danner diatomiske molekyler.
Denne lighed i egenskaber skyldes det faktum, at elementer i den samme gruppe har det samme antal valenselektroner , som er elektronerne i den yderste skal af et atom. Disse valenselektroner er ansvarlige for et elements kemiske opførsel.
Sidste artikelHvad er 180 gram salt til Oz?
Næste artikelHvordan dannes jord ozon?
 Varme artikler
Varme artikler
-
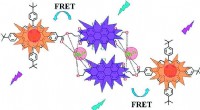 Triplex-signal kemosensor til det blotte øje og spektrometrisk ledningsdetektionKredit:Wiley Miljømæssig blyeksponering er en af de største folkesundhedstrusler på verdensplan. Følgelig, pålidelig, hurtig, billig, og let at håndtere blyanalyser er et presserende behov. Fors
Triplex-signal kemosensor til det blotte øje og spektrometrisk ledningsdetektionKredit:Wiley Miljømæssig blyeksponering er en af de største folkesundhedstrusler på verdensplan. Følgelig, pålidelig, hurtig, billig, og let at håndtere blyanalyser er et presserende behov. Fors -
 Gecko -adhæsionsteknologi bevæger sig tættere på industrielle anvendelserEn undersøgelse ved Georgia Institute of Technology undersøgte egenskaber ved gekkoadhæsionsteknologi. Kredit:Rob Felt, Georgia Tech En gekko, der springer op ad en væg eller på tværs af et loft,
Gecko -adhæsionsteknologi bevæger sig tættere på industrielle anvendelserEn undersøgelse ved Georgia Institute of Technology undersøgte egenskaber ved gekkoadhæsionsteknologi. Kredit:Rob Felt, Georgia Tech En gekko, der springer op ad en væg eller på tværs af et loft, -
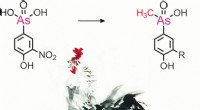 Methylerede phenylarseniske metabolitter identificeret i kyllingeleverKosttilskud, der indeholder arsen, har været forbudt i EU siden 1999 og i Nordamerika siden 2013. I mange lande tilsættes de stadig til fjerkræfoder for at forhindre parasitinfektion og fremme vægtøgn
Methylerede phenylarseniske metabolitter identificeret i kyllingeleverKosttilskud, der indeholder arsen, har været forbudt i EU siden 1999 og i Nordamerika siden 2013. I mange lande tilsættes de stadig til fjerkræfoder for at forhindre parasitinfektion og fremme vægtøgn -
 Forskere identificerer bioaktive forbindelser i kakaobælge for at udvikle lægemidler til bekæmpel…María de la Luz Cádiz Gurrea. Kredit:Universitetet i Granada Et internationalt team af forskere, ledet af University of Granada (UGR) i Spanien, har med succes isoleret en bioaktiv forbindelse til
Forskere identificerer bioaktive forbindelser i kakaobælge for at udvikle lægemidler til bekæmpel…María de la Luz Cádiz Gurrea. Kredit:Universitetet i Granada Et internationalt team af forskere, ledet af University of Granada (UGR) i Spanien, har med succes isoleret en bioaktiv forbindelse til
- Angreb eller tilbagetog? Kredsløb forbinder sult og forfølgelse i havsneglens hjerne
- Amerikanerne bliver mere socialt isolerede, men de føler sig ikke mere ensomme
- Hvor gode bakterier styrer dine gener
- Sådan testes en rock for guld
- Hvordan rødder finder en rute
- Erfaring fra sorte doktorander understreger behov for at øge mangfoldigheden inden for STEM -felter


