Hvordan ville du forudsige, om der opstår en dobbeltstatningsreaktion uden at blande kemikalierne?
1. Identificer reaktanterne:
* Start med at identificere reaktanterne og deres kemiske formler.
* Dobbeltudskiftningsreaktioner involverer generelt to ioniske forbindelser.
2. Forudsig produkterne:
* Forestil dig de positive og negative ioner af reaktanterne, der skifter partnere.
* Skriv de kemiske formler for de potentielle produkter.
3. Kontroller for opløselighed:
* Brug et opløselighedskort eller din viden om opløselighedsregler for at bestemme, om nogen af de potentielle produkter er uopløselige i vand.
* uopløselig Produkter vil danne A bundfald (fast) og angive en reaktion er sket.
* opløselig Produkter vil forblive opløst, og der vil ikke blive observeret nogen synlig reaktion.
4. Overvej andre faktorer:
* Gasdannelse: Nogle dobbeltstatningsreaktioner producerer gasser, såsom kuldioxid (CO2) eller hydrogensulfid (H2S). Hvis der dannes en gas, vil reaktionen forekomme.
* Dannelse af svage elektrolytter: Reaktioner, der danner en svag elektrolyt (såsom vand), kan også føre til en dobbeltstatningsreaktion fremad.
* neutraliseringsreaktioner: Reaktioner mellem en syre og en base er altid dobbeltstatningsreaktioner, der danner salt og vand.
Eksempel:
Lad os forudsige, om en reaktion vil forekomme mellem sølvnitrat (AGNO3) og natriumchlorid (NaCl) .
* reaktanter: AGNO3 (aq) og NaCl (aq)
* Potentielle produkter: AGCL (S) og Nano3 (aq)
* opløselighed: AGCL er uopløselig i vand, mens Nano3 er opløselig .
* Konklusion: Da AGCL er uopløselig, er A bundfald vil dannes, hvilket indikerer, at der er sket en reaktion.
Vigtig note:
* Selvom disse retningslinjer er nyttige, er de ikke idiotsikre. Nogle gange kan reaktioner, der ser ud til at være ugunstige baseret på disse regler, stadig forekomme i lille grad.
* For endeligt at bestemme, om der vil forekomme en reaktion, skal du eksperimentelt teste reaktionen.
 Varme artikler
Varme artikler
-
 CRISPR:Mere end blot til genredigering?Den internationale forside af et nyligt nummer af Angewandte Chemie viser billedet fra ECRISPR-forskningen. Kredit: Angewandte Chemie Genredigeringsværktøjet CRISPR er blevet udråbt som et vide
CRISPR:Mere end blot til genredigering?Den internationale forside af et nyligt nummer af Angewandte Chemie viser billedet fra ECRISPR-forskningen. Kredit: Angewandte Chemie Genredigeringsværktøjet CRISPR er blevet udråbt som et vide -
 Forskydningskraft:Hvor gode materialer bliver gjort bedreMaterialeforskerne Arun Devaraj og Bharat Gwalani (forgrunden) bruger et pin-on-disk tribometer til at give forskydningsdeformation i materialer. Kredit:Arun Devaraj | Pacific Northwest National Labor
Forskydningskraft:Hvor gode materialer bliver gjort bedreMaterialeforskerne Arun Devaraj og Bharat Gwalani (forgrunden) bruger et pin-on-disk tribometer til at give forskydningsdeformation i materialer. Kredit:Arun Devaraj | Pacific Northwest National Labor -
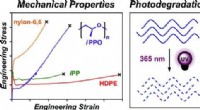 Kemikere skaber hurtigere nedbrydende plast til marinebrugKredit:ACS For at løse plastikmiljøkrisen, Cornell-kemikere har udviklet en ny polymer med rigelig styrke i marine omgivelser, der er klar til at nedbrydes af ultraviolet stråling, ifølge forsknin
Kemikere skaber hurtigere nedbrydende plast til marinebrugKredit:ACS For at løse plastikmiljøkrisen, Cornell-kemikere har udviklet en ny polymer med rigelig styrke i marine omgivelser, der er klar til at nedbrydes af ultraviolet stråling, ifølge forsknin -
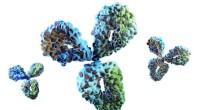 I et felt, hvor mindre er bedre, forskere opdager verdens mindste antistofferFuldstændig struktur af et antistof, viser dens domæner. Kredit:University of Bath Forskere ved University of Bath i Storbritannien og biofarmavirksomheden UCB har fundet en måde at producere mini
I et felt, hvor mindre er bedre, forskere opdager verdens mindste antistofferFuldstændig struktur af et antistof, viser dens domæner. Kredit:University of Bath Forskere ved University of Bath i Storbritannien og biofarmavirksomheden UCB har fundet en måde at producere mini
- Forskere rapporterer mikro-CT-scanning af et musembryo ved en hidtil uset opløsning
- Hvad er en sømil, og hvordan adskiller den sig fra en normal mi
- NZ's fossiler viser, at flere arter levede i varmere farvande, men de nuværende opvarmningstendense…
- Sådan forklares divisionen til en tredje grader
- Hvordan tarmen erstatter og reparerer sig selv
- Verden skal skære ned på kødforbruget for at redde klimaet:undersøgelse


