Hvad er koefficient i en kemisk reaktion?
Her er en sammenbrud:
* afbalancering af kemiske ligninger: Kemiske reaktioner skal overholde loven om bevarelse af masse. Dette betyder, at antallet af atomer i hvert element på reaktantsiden (udgangsmaterialerne) skal svare til antallet af atomer i dette element på produktsiden (de dannede stoffer). Koefficienter bruges til at afbalancere ligningen.
* støkiometri: Koefficienter tilvejebringer det kvantitative forhold mellem reaktanter og produkter. De tillader os at beregne, hvor meget af hver reaktant der er behov for for at fremstille en vis mængde produkt, eller hvor meget produkt der kan dannes fra en given mængde reaktant.
Eksempel:
Overvej forbrænding af metan:
`` `
CH4 + 2O2 → CO2 + 2H2O
`` `
* Koefficienter: Koefficienterne er henholdsvis 1, 2, 1 og 2.
* Fortolkning: Denne ligning fortæller os, at en mol methan (CH4) reagerer med to mol ilt (O2) for at producere en mol kuldioxid (CO2) og to mol vand (H2O).
Nøglepunkter:
* Koefficienter gælder for hele molekylet/forbindelsen, de går forud for.
* De kan være hele tal eller fraktioner.
* De er ikke de samme som underskrifter, der angiver antallet af atomer i hvert element i et molekyle.
At forstå koefficienter er afgørende for at mestre støkiometri og gøre nøjagtige forudsigelser om kemiske reaktioner.
Sidste artikelBordsalt er resultatet af?
Næste artikelHvilken egenskab ved eddike kan du undersøge gennem sans alene?
 Varme artikler
Varme artikler
-
 Ny 3-D-printet teknologi sænker omkostningerne ved almindelig medicinsk testUConn kandidatstuderende Mohamed Sharafeldin, og hans rådgiver, kemi professor James Rusling, udviklet en måde at 3D-printe en pipettespids på. Kredit:Sean Flynn/UConn Photo Et ønske om en enklere
Ny 3-D-printet teknologi sænker omkostningerne ved almindelig medicinsk testUConn kandidatstuderende Mohamed Sharafeldin, og hans rådgiver, kemi professor James Rusling, udviklet en måde at 3D-printe en pipettespids på. Kredit:Sean Flynn/UConn Photo Et ønske om en enklere -
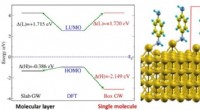 Energiniveaujustering for molekylær elektronik(Venstre) Figur viser elektronenerginiveaujusteringen af benzen-diaminmolekyler på guldoverfladesystemet (vist til højre). Energiniveauerne er vist for et molekylært lag (sort) og for et enkelt mole
Energiniveaujustering for molekylær elektronik(Venstre) Figur viser elektronenerginiveaujusteringen af benzen-diaminmolekyler på guldoverfladesystemet (vist til højre). Energiniveauerne er vist for et molekylært lag (sort) og for et enkelt mole -
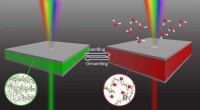 Smarte vinduer, der selvlyser på regnvejrsdageKredit:Pohang University of Science &Technology (POSTECH) Smarte vinduer, der automatisk skifter farver afhængigt af sollysets intensitet, får opmærksomhed, da de kan reducere energiregningen ved
Smarte vinduer, der selvlyser på regnvejrsdageKredit:Pohang University of Science &Technology (POSTECH) Smarte vinduer, der automatisk skifter farver afhængigt af sollysets intensitet, får opmærksomhed, da de kan reducere energiregningen ved -
 Polystyrenaffald er overalt, og det er ikke biologisk nedbrydeligt. Forskere har lige fundet en måd…Kredit:ACS Forskere ved U.S. Department of Energys Ames Laboratory og deres partnere fra Clemson University har opdaget en grøn, lavenergiproces til at nedbryde polystyren, en type plast, der er m
Polystyrenaffald er overalt, og det er ikke biologisk nedbrydeligt. Forskere har lige fundet en måd…Kredit:ACS Forskere ved U.S. Department of Energys Ames Laboratory og deres partnere fra Clemson University har opdaget en grøn, lavenergiproces til at nedbryde polystyren, en type plast, der er m
- Hvilken gudinde er opkaldt efter Mars?
- Hvilken type grænse er Pacific Ring Fire?
- Ved at bytte kød til fisk og skaldyr kan det forbedre ernæringen og reducere emissionerne
- Hvilke intermolekylære kræfter er der mellem molekylerne NaCl i H2O?
- Hvilken type væv danner den ydre overflade krop?
- Hvor finder du alpine gletsjere?


