Struktur og binding af brintsulfid?
Struktur og binding af hydrogensulfid (H₂S)
struktur:
* molekylær form: Bøjet eller V-formet.
* Bond vinkel: Ca. 92 °.
* Hybridisering: sp 3 Hybridisering på svovlatomet.
* Polaritet: Polært molekyle.
binding:
* type obligationer: To kovalente bindinger mellem svovl og hvert hydrogenatom.
* Elektronegativitet: Svovl (2,58) er mere elektronegativ end brint (2,20).
* polære kovalente obligationer: På grund af forskellen i elektronegativitet forskydes elektronparret i hver S-H-binding let mod svovlatomet, hvilket skaber en delvis negativ ladning på svovl og en delvis positiv ladning på hvert hydrogenatom. Dette resulterer i en polær kovalent binding.
* Ensomme par: Svovl har to ensomme par elektroner, der er ansvarlige for molekylets bøjede form og bidrager til dens polaritet.
diagram:
`` `
H
|
S
/ \
H h
`` `
egenskaber:
* lugt: Rotten æg lugt.
* Farveløs gas Ved stuetemperatur.
* giftig og brandfarlig.
* opløselighed: Lidt opløselig i vand.
Nøglepunkter:
* Den bøjede form af H₂s skyldes tilstedeværelsen af ensomme par på svovlatomet, der afviser bindingselektronparene.
* Polariteten af H₂S skyldes den ulige deling af elektroner i S-H-bindingerne, hvilket skaber et dipolmoment.
* Egenskaberne ved H₂s påvirkes af dens struktur og binding. For eksempel skyldes dens stærke lugt dens evne til at interagere med lugtreceptorer i næsen.
I resumé har H₂S en bøjet form, polære kovalente bindinger og to ensomme par på svovlatomet. Dens struktur og bindingsegenskaber er ansvarlige for dens karakteristiske egenskaber, herunder dens stærke lugt, toksicitet og antændelighed.
 Varme artikler
Varme artikler
-
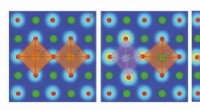 Simuleringer identificerer betydningen af gitterforvrængninger i ionledende brændselscellemateri…Illustrationerne viser, hvordan sammenhængen mellem gitterforvrængning og protonbindingsenergi i et materiale påvirker protonledning i forskellige miljøer. At formindske denne interaktion kan hjælpe f
Simuleringer identificerer betydningen af gitterforvrængninger i ionledende brændselscellemateri…Illustrationerne viser, hvordan sammenhængen mellem gitterforvrængning og protonbindingsenergi i et materiale påvirker protonledning i forskellige miljøer. At formindske denne interaktion kan hjælpe f -
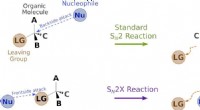 Udvikling af en fundamental reaktion i organisk kemi - opdagelse af en ny nukleofil substitutionsrea…Skema af lærebogen SN2 nukleofil substitutionsreaktion, og den nyopdagede SN2X-reaktion. Kredit:School of Physical and Mathematical Sciences, Nanyang Teknologiske Universitet Nukleofil substitutio
Udvikling af en fundamental reaktion i organisk kemi - opdagelse af en ny nukleofil substitutionsrea…Skema af lærebogen SN2 nukleofil substitutionsreaktion, og den nyopdagede SN2X-reaktion. Kredit:School of Physical and Mathematical Sciences, Nanyang Teknologiske Universitet Nukleofil substitutio -
 Overraskende opdagelse kan ændre den måde, industrien bruger nikkel påSEM-billede af korroderet nikkel på overfladen. Kredit:Mengying Liu Nikkel er et af de mest udbredte grundstoffer på jorden. Det er svært, dog formbar, magnetisk ved stuetemperatur, og en relativt
Overraskende opdagelse kan ændre den måde, industrien bruger nikkel påSEM-billede af korroderet nikkel på overfladen. Kredit:Mengying Liu Nikkel er et af de mest udbredte grundstoffer på jorden. Det er svært, dog formbar, magnetisk ved stuetemperatur, og en relativt -
 Forskere laver plastikfilm, der undertrykker coronavirusBillede af den ultrastrukturelle morfologi udstillet af 2019 Novel Coronavirus (2019-nCoV). Kredit:CDC Et konsortium bestående af firmaer Braskem, AplFilm og Nanox og universiteterne UFSCar (Brasi
Forskere laver plastikfilm, der undertrykker coronavirusBillede af den ultrastrukturelle morfologi udstillet af 2019 Novel Coronavirus (2019-nCoV). Kredit:CDC Et konsortium bestående af firmaer Braskem, AplFilm og Nanox og universiteterne UFSCar (Brasi
- Der er behov for dybe transformationer for at nå målene for bæredygtig udvikling
- Den norske chef siger ingen planer om at sælge budgettransportør
- Nyt perspektiv på forholdet mellem størrelse og intensitet af tropiske cykloner
- Sådan beregnes KCAT og VMAX
- Vådcelle batteri Vs. Tørcellebatteri
- Tørke ansporer til ekstreme foranstaltninger for at beskytte Vestens vilde heste


