Er molmasse forskellig i isoelektronisk forbindelse?
Her er hvorfor:
* isoelektronisk betyder, at to arter har det samme antal elektroner. De har dog ikke nødvendigvis det samme antal protoner.
* molmasse er massen af en mol af et stof, der er direkte relateret til antallet af protoner i kernen i et atom.
Eksempler:
* n³⁻, o²⁻, f⁻ er alle isoelektroniske, hvilket betyder, at de har 10 elektroner hver. Deres molære masser er imidlertid forskellige:
* Nitrogen (n):14,01 g/mol
* Oxygen (O):16,00 g/mol
* Fluor (F):19,00 g/mol
Forskellen i molmasse opstår, fordi hvert element har et andet antal protoner.
Kortfattet: Mens isoelektroniske arter har det samme antal elektroner, kan deres molære masser være forskellige på grund af variationer i antallet af protoner i deres atomer.
 Varme artikler
Varme artikler
-
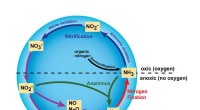 Undersøgelse af forviklingerne i nitrogenkredsløbetDenne grafik fremhæver nogle af de vigtigste reaktioner i nitrogenkredsløbet, skudt i gang med brugen af ammoniak eller NH3 , gødning. MSUs nye forskning zoomer ind på reaktioner, der involverer nit
Undersøgelse af forviklingerne i nitrogenkredsløbetDenne grafik fremhæver nogle af de vigtigste reaktioner i nitrogenkredsløbet, skudt i gang med brugen af ammoniak eller NH3 , gødning. MSUs nye forskning zoomer ind på reaktioner, der involverer nit -
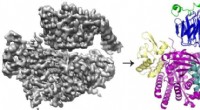 Undersøgelse afslører den indviklede måde, hvorpå to proteiner interagerer for at fremme cellebe…Cryo-EM 3D-rekonstruktionen (til venstre) af proteinet P-Rex1 bundet til Gβγ og proteinmodellen (til højre), der viser, at Gβγ (øverst; blå og grøn) binder til en kompakt, multi-domæne overflade på P-
Undersøgelse afslører den indviklede måde, hvorpå to proteiner interagerer for at fremme cellebe…Cryo-EM 3D-rekonstruktionen (til venstre) af proteinet P-Rex1 bundet til Gβγ og proteinmodellen (til højre), der viser, at Gβγ (øverst; blå og grøn) binder til en kompakt, multi-domæne overflade på P- -
 Bakterier fra varme kilder løser stofskiftets mysteriumBakterierne Thermus thermophilus lever i varme kilder. Kredit:Peter Brzezinski Forbrænding er ofte en hurtig proces, som i tilfælde af brand. Hvordan kan celler kontrollere brændingsprocessen så g
Bakterier fra varme kilder løser stofskiftets mysteriumBakterierne Thermus thermophilus lever i varme kilder. Kredit:Peter Brzezinski Forbrænding er ofte en hurtig proces, som i tilfælde af brand. Hvordan kan celler kontrollere brændingsprocessen så g -
 Sætte fejl på menuen, sikkertKredit:Pixabay/CC0 Public Domain Tanken om at spise insekter er mavedrejning for mange, men ny forskning fra Edith Cowan University (ECU) kaster lys over allergifremkaldende proteiner, som kan udg
Sætte fejl på menuen, sikkertKredit:Pixabay/CC0 Public Domain Tanken om at spise insekter er mavedrejning for mange, men ny forskning fra Edith Cowan University (ECU) kaster lys over allergifremkaldende proteiner, som kan udg
- Hvordan forklarer havbundens spredning kontinentaldrift?
- En fodprotese, der tackler hårdt terræn
- En CNN-baseret metode til matematisk formelscript og typeidentifikation
- Hvordan 'ekstracellulære chaperoner' hjælper med at fjerne unormale proteiner
- NASAs første kvindelige astronautkandidat, Jerrie Cobb, dør
- Cypern-racere viser, at budgetsolbiler har en solrig fremtid


