Hvad er kogepunktet for en løsning?
Faktorer, der påvirker kogepunktet for en løsning:
* opløsningsmiddel: Kogepunktet for det rene opløsningsmiddel er udgangspunktet.
* opløst: Tilstedeværelsen af et opløst stof ændrer kogepunktet.
* Koncentration af opløsningen: Jo højere koncentration af opløstelsen er, jo større er ændringen i kogepunkt.
* arten af det opløste stof: Nogle opløste stoffer har større indflydelse på kogepunktet end andre.
Kogepunkthøjde:
* Kolligativ egenskab: Ændringen i kogepunkt er en kolligativ egenskab, hvilket betyder, at den kun afhænger af antallet af opløste partikler i opløsningen, ikke af typen af opløst stof.
* Formel: ΔT b =K b * m
* ΔT b er kogepunkthøjden (forskellen mellem kogepunktet for opløsningen og kogepunktet for det rene opløsningsmiddel).
* K b er den ebullioscopic -konstant, en egenskab, der er specifik for opløsningsmidlet.
* m er molaliteten af opløsningen (mol opløst stof pr. Kg opløsningsmiddel).
Eksempel:
En opløsning af salt (NaCl) i vand vil have et højere kogepunkt end rent vand. Dette skyldes, at saltionerne forstyrrer vandmolekylernes interaktioner, hvilket gør det sværere for dem at flygte ind i dampfasen.
Nøglepunkter:
* Løsninger har generelt højere kogepunkter end deres rene opløsningsmidler.
* Kogepunkthøjden er direkte proportional med molaliteten af opløsningen.
* Kogepunkthøjden er en nyttig egenskab til bestemmelse af den molære masse af et opløst stof.
Fortæl mig, hvis du har nogen specifikke scenarier, du gerne vil udforske!
 Varme artikler
Varme artikler
-
 Ny syntesemetode til fremstilling af fluorerede piperidinerTrykbeholder (autoklave) til hydrogenering af fluorerede pyridiner. Reaktionerne udføres ved et hydrogentryk på 50 bar (normalt atmosfærisk tryk er 1 bar). Kredit:Frank Glorius Syntetiske molekyle
Ny syntesemetode til fremstilling af fluorerede piperidinerTrykbeholder (autoklave) til hydrogenering af fluorerede pyridiner. Reaktionerne udføres ved et hydrogentryk på 50 bar (normalt atmosfærisk tryk er 1 bar). Kredit:Frank Glorius Syntetiske molekyle -
 Forskere opdager ny teknik til at teste for virusinfektionerBrian Geiss holder en wire, der er en fjerdedel af størrelsen af et menneskehår. Kredit:John Eisele/ CSU Photography Et hold forskere fra Colorado State University har udviklet teknologi, der ka
Forskere opdager ny teknik til at teste for virusinfektionerBrian Geiss holder en wire, der er en fjerdedel af størrelsen af et menneskehår. Kredit:John Eisele/ CSU Photography Et hold forskere fra Colorado State University har udviklet teknologi, der ka -
 Fremtidige biler kan fremstilles af revolutionerende nyt materialeKredit:CC0 Public Domain Et nyt materiale, der er så stift som metal, men fleksibelt nok til at modstå kraftige vibrationer, kan forvandle bilindustrien, siger eksperter fra University of Surrey.
Fremtidige biler kan fremstilles af revolutionerende nyt materialeKredit:CC0 Public Domain Et nyt materiale, der er så stift som metal, men fleksibelt nok til at modstå kraftige vibrationer, kan forvandle bilindustrien, siger eksperter fra University of Surrey. -
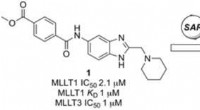 Opdagelse af selektive kemiske prober, der hæmmer epigenetiske faktorer for akut myeloid leukæmiKredit:Wiley Nogle alvorlige former for leukæmi udvikler sig, fordi proteiner på det epigenetiske niveau mister deres regulerende funktion. Nu, i et bredt internationalt samarbejde, Britiske forsk
Opdagelse af selektive kemiske prober, der hæmmer epigenetiske faktorer for akut myeloid leukæmiKredit:Wiley Nogle alvorlige former for leukæmi udvikler sig, fordi proteiner på det epigenetiske niveau mister deres regulerende funktion. Nu, i et bredt internationalt samarbejde, Britiske forsk
- Den filippinske minister forbyder nye åbne miner til en værdi af $ 8 mia
- At lære gammel teknologi nye tricks
- Huller i fossile skaller viser virkningerne af konkurrence og evolution
- Luftkvalitet og sundhedspåvirkning fra Saddleworth Moor Fire i 2018 i Nordengland
- Hvad sker der, når du tilføjer eddike til skalleskaller?
- Undersøgelse afslører, hvordan menneskeheden kunne forene sig for at løse globale udfordringer


