Hvorfor kaldes neon og helium ædle gasser?
* Fuld ydre elektronskaller: Den vigtigste grund er deres elektronkonfiguration. Både neon og helium har fuldstændigt fyldte ydre elektronskaller. Dette betyder, at de har et stabilt arrangement af elektroner og er ekstremt tilbageholdende med at miste eller få elektroner til at danne bindinger.
* Høj ioniseringsenergi: Det kræver en masse energi at fjerne et elektron fra et ædelgasatom. Denne høje ioniseringsenergi gør dem resistente over for at danne positive ioner.
* Lav elektronaffinitet: Noble gasser har også meget lav elektronaffinitet, hvilket betyder, at de ikke let accepterer ekstra elektroner til at danne negative ioner.
Analogien til et fuldt hus: Forestil dig ædle gasser som mennesker, der bor i et hus med alle værelser komfortabelt besat. De behøver ikke at dele deres plads eller invitere andre ind. De er tilfredse med at være "ædel" og uafhængige.
Andre ædle gasser: Neon og Helium er kun to medlemmer af Noble Gas -familien, som også inkluderer Argon, Krypton, Xenon og Radon. Alle deler de samme egenskaber ved stabilitet og lav reaktivitet.
Undtagelser: Mens ædle gasser generelt er ureaktive, er der nogle undtagelser. For eksempel kan Xenon danne forbindelser med meget elektronegative elementer som fluor og ilt.
 Varme artikler
Varme artikler
-
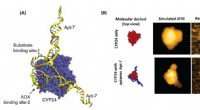 Lovende anticancer-molekyle identificeretFigur 1. En integreret tilgang til HS-AFM og molekylær docking for at afsløre bindingsmekanismen for Apt-7 til CYP24 (A) Den tredimensionelle visning af de toprangerede dockede konformationer af CYP24
Lovende anticancer-molekyle identificeretFigur 1. En integreret tilgang til HS-AFM og molekylær docking for at afsløre bindingsmekanismen for Apt-7 til CYP24 (A) Den tredimensionelle visning af de toprangerede dockede konformationer af CYP24 -
 Forskere afslører ny dobbelt-roaming-mekanisme i kemisk reaktion3D polært plot for produktets translationelle energi og vinkelfordelinger. Kredit:FU Yanlin Roaming, en ny mekanisme i reaktionsdynamik, beskriver en usædvanlig vej, der er ret forskellig fra den
Forskere afslører ny dobbelt-roaming-mekanisme i kemisk reaktion3D polært plot for produktets translationelle energi og vinkelfordelinger. Kredit:FU Yanlin Roaming, en ny mekanisme i reaktionsdynamik, beskriver en usædvanlig vej, der er ret forskellig fra den -
 Ny teknik muliggør 3D-print med pasta af silikonepartikler i vandNy teknik udgivet i Avancerede materialer viser processen med 3-D-print af silikonegummi. Kredit:Orlin Velev, NC State University Ved at bruge principperne bag dannelsen af sandslotte fra vådt
Ny teknik muliggør 3D-print med pasta af silikonepartikler i vandNy teknik udgivet i Avancerede materialer viser processen med 3-D-print af silikonegummi. Kredit:Orlin Velev, NC State University Ved at bruge principperne bag dannelsen af sandslotte fra vådt -
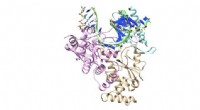 Trækker stikket på coronavirus kopimaskineAntiviralt lægemiddel remdesivir udgør hovedlinjen i FDA-godkendt terapeutisk forsvar mod COVID-19-virussen. Forskere ved University of North Texas bruger Frontera-supercomputeren til at modellere, hv
Trækker stikket på coronavirus kopimaskineAntiviralt lægemiddel remdesivir udgør hovedlinjen i FDA-godkendt terapeutisk forsvar mod COVID-19-virussen. Forskere ved University of North Texas bruger Frontera-supercomputeren til at modellere, hv
- Space mining kits eksploderer til test i kredsløb
- Fra tvungne kys til magtubalancer tyder forskning på, at vold mod kvinder i sport er endemisk
- Har alle celler den samme sammensætning?
- Hvad er hastigheden Boeing 747?
- Mobilchip-titanen Qualcomm står over for tilbageslag med amerikansk antitrust-dom
- Skyrmions hvirvler viser løfte om lavenergi-computerkredsløb


