Hvordan adskiller de stoffer, der dannes i en kemisk reaktion, fra reaktion?
1. Kemisk sammensætning:
* reaktanter: De stoffer, der er til stede inden reaktionen, finder sted. De har deres egne unikke kemiske formler og kompositioner.
* Produkter: De stoffer, der er dannet som et resultat af den kemiske reaktion. De har nye og forskellige kemiske formler og sammensætninger sammenlignet med reaktanterne.
2. Kemiske bindinger:
* reaktanter: Har eksisterende kemiske bindinger mellem deres atomer.
* Produkter: Har nye og forskellige kemiske bindinger dannet mellem atomer. Dette er den grundlæggende ændring, der definerer en kemisk reaktion.
3. Egenskaber:
* reaktanter: Har specifikke fysiske og kemiske egenskaber, som smeltepunkt, kogepunkt, farve, reaktivitet osv.
* Produkter: Har typisk forskellige fysiske og kemiske egenskaber sammenlignet med reaktanterne. Denne forskel i egenskaber er ofte grundlaget for at observere, at der er sket en reaktion.
4. Energi:
* reaktanter: Har et bestemt energiniveau.
* Produkter: Har et andet energiniveau end reaktanterne. Kemiske reaktioner kan enten frigive energi (eksoterme) eller absorbere energi (endotermisk).
Eksempel:
Overvej reaktionen af brintgas (H₂) og iltgas (O₂) til dannelse af vand (H₂O):
reaktanter: H₂ og O₂
Produkter: H₂o
* Den kemiske sammensætning ændres:brint- og iltatomer omarrangeres for at danne vandmolekyler.
* De kemiske bindinger ændres:Bindingerne mellem brint- og iltatomer i reaktanterne er brudt, og nye bindinger mellem brint- og iltatomer dannes i produktet.
* Egenskaberne ændres:brint og ilt er gasser ved stuetemperatur, mens vand er en væske.
* Energiændringer:Denne reaktion frigiver energi (eksotermisk) og ledsages af varme og lys.
Kortfattet:
Kemiske reaktioner involverer brud og dannelse af nye kemiske bindinger, hvilket fører til dannelse af produkter med forskellige kemiske sammensætninger, egenskaber og energiniveau sammenlignet med reaktanterne.
Sidste artikelHvordan blev Bohrium brugt til?
Næste artikelHvor mange væsentlige tal er den atomiske masse af lithium givet?
 Varme artikler
Varme artikler
-
 Grønnere molekylære mellemprodukter kan hjælpe lægemiddeldesignLászló Kürti er på billedet. Kredit:Jeff Fitlow/Rice University Forskere ved Rice University har forenklet deres tilgang til at syntetisere en meget alsidig familie af prækursorer på vej til biolo
Grønnere molekylære mellemprodukter kan hjælpe lægemiddeldesignLászló Kürti er på billedet. Kredit:Jeff Fitlow/Rice University Forskere ved Rice University har forenklet deres tilgang til at syntetisere en meget alsidig familie af prækursorer på vej til biolo -
 Sådan afkøles en smartphonePrøve af materialet. Kredit:NUST MISIS NUST MISIS-forskere har udviklet kompositter, der leder varme mange gange bedre end deres modstykker og endda er genstand for enkel og billig forarbejdning.
Sådan afkøles en smartphonePrøve af materialet. Kredit:NUST MISIS NUST MISIS-forskere har udviklet kompositter, der leder varme mange gange bedre end deres modstykker og endda er genstand for enkel og billig forarbejdning. -
 Belysning af hydrogeler via nanomaterialerDenne visuelle fremstilling demonstrerer, hvordan lys? Reagerende hydrogeler absorberer og konverterer nær-infrarødt lys til varme, som kan udvikles til at styre termoresponsive materialer. Kredit:Dr.
Belysning af hydrogeler via nanomaterialerDenne visuelle fremstilling demonstrerer, hvordan lys? Reagerende hydrogeler absorberer og konverterer nær-infrarødt lys til varme, som kan udvikles til at styre termoresponsive materialer. Kredit:Dr. -
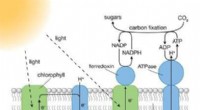 Forskere designer molekylær system til kunstig fotosynteseFotosystemer (PS) I og II er store proteinkomplekser, der indeholder lysabsorberende pigmentmolekyler, der er nødvendige for fotosyntese. PS II fanger energi fra sollys for at udtrække elektroner fra
Forskere designer molekylær system til kunstig fotosynteseFotosystemer (PS) I og II er store proteinkomplekser, der indeholder lysabsorberende pigmentmolekyler, der er nødvendige for fotosyntese. PS II fanger energi fra sollys for at udtrække elektroner fra
- Er godt fremmøde lig med gode karakterer?
- Hvad er den største forskel mellem geocentriske og helicentriske modeller af solsystemet?
- Granitter kunne løse gåden med at finde metaller, der er afgørende for teknologi med lavt kulstof…
- G7 forpligter sig til at reducere plastproduktionen:Fransk ministerium
- Sten-jern meteor forårsagede august nedslagsblink ved Jupiter
- Et grønt batteri til hjemmebrug i landdistrikterne i Afrika


