Hvordan beskriver en molekylær formel forbindelse?
1. Typer af atomer til stede: Det viser symbolerne på de elementer, der udgør forbindelsen. For eksempel fortæller H₂O os, at vand indeholder brint (H) og ilt (O) atomer.
2. Antal af hver type atom: Det bruger underskrifter til at indikere antallet af atomer i hvert element i molekylet. I H₂O indikerer underskriften 2, at der er to hydrogenatomer, og underskriften 1 (forstået) indikerer, at der er et iltatom.
3. Samlet antal atomer: Summen af underskrifterne fortæller os det samlede antal atomer i molekylet. H₂O har i alt 3 atomer (2 hydrogen + 1 ilt).
4. Empirisk formel: Den molekylære formel kan forenkles til den empiriske formel, der repræsenterer det enkleste hele nummerforhold for atomer i forbindelsen. For eksempel er den molekylære formel af glukose c₆h₁₂o₆, men dens empiriske formel er ch₂o.
5. Molekylvægt: Den molekylære formel giver os mulighed for at beregne molekylvægten af forbindelsen ved at tilføje atomvægtene for alle atomer i molekylet.
Begrænsninger:
Mens en molekylær formel er nyttig, giver den ikke følgende information:
* struktur: Det fortæller os ikke, hvordan atomerne er arrangeret i rummet.
* isomerer: Forbindelser med den samme molekylære formel, men forskellige arrangementer af atomer kaldes isomerer. Den molekylære formel skelner ikke mellem isomerer.
* binding: Det giver ikke oplysninger om de typer bindinger mellem atomer.
Eksempler:
* h₂o: Vand, to hydrogenatomer og et iltatom
* co₂: Kuldioxid, et carbonatom og to iltatomer
* c₆h₁₂o₆: Glukose, seks carbonatomer, tolv hydrogenatomer og seks iltatomer
Sammenfattende giver en molekylær formel en kortfattet og nøjagtig måde at repræsentere sammensætningen af en forbindelse ved at specificere de typer og antallet af tilstedeværende atomer. Det er et afgørende værktøj i kemi til forståelse og kommunikation om kemiske stoffer.
Sidste artikelHvad er kemisk formel for mayonnaise?
Næste artikelWhere are protons and neutrins located?
 Varme artikler
Varme artikler
-
 Fosforbaserede kompositter som anodematerialer til kalium-ion-batterierSkematisk illustration af de fosforbaserede kompositter som anodematerialer til KIBer. Kredit:WU Ying og HUANG Haibo Prof. WU Zhongshuai fra Dalian Institute of Chemical Physics (DICP) ved det kin
Fosforbaserede kompositter som anodematerialer til kalium-ion-batterierSkematisk illustration af de fosforbaserede kompositter som anodematerialer til KIBer. Kredit:WU Ying og HUANG Haibo Prof. WU Zhongshuai fra Dalian Institute of Chemical Physics (DICP) ved det kin -
 Nye ID-billeder af ledende polymerer opdager en overraskende ABBA-fanSTM-billede, der viser, hvordan detaljerne i strukturen af C14DPPF-F kan ses - denne nye teknik, der giver submolekylær opløsning af polymerrygraden og interdigitation af alkylsidekæderne. Hvide pil
Nye ID-billeder af ledende polymerer opdager en overraskende ABBA-fanSTM-billede, der viser, hvordan detaljerne i strukturen af C14DPPF-F kan ses - denne nye teknik, der giver submolekylær opløsning af polymerrygraden og interdigitation af alkylsidekæderne. Hvide pil -
 Gennemstrømningselektroder gør brint 50 gange hurtigereEt eksempel på de små, gennemstrømningselektrode, som Duke-forskere brugte til at producere mere brint fra elektrolyse med en krone til skala. Kredit:Wiley Lab, Duke University Elektrolyse, passer
Gennemstrømningselektroder gør brint 50 gange hurtigereEt eksempel på de små, gennemstrømningselektrode, som Duke-forskere brugte til at producere mere brint fra elektrolyse med en krone til skala. Kredit:Wiley Lab, Duke University Elektrolyse, passer -
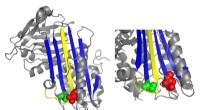 Hvad en sjælden blodsygdom kan lære os om blodpropperEt bånddiagram af antithrombin fremhæver placeringer af funktionelt vigtige mutationer. Kredit:Irene Martinez-Martinez Når en person kommer til skade, blodpropper er afgørende. Imidlertid, når far
Hvad en sjælden blodsygdom kan lære os om blodpropperEt bånddiagram af antithrombin fremhæver placeringer af funktionelt vigtige mutationer. Kredit:Irene Martinez-Martinez Når en person kommer til skade, blodpropper er afgørende. Imidlertid, når far
- En model kendt som et, hvad der bruger DNA -sammenligninger til at estimere den tid, hvor arter har …
- I hvilke stater tager noget af form af en beholder?
- Kunne et gamma-stråleudbrud udslette alt liv på Jorden?
- Kan et donorkuponprogram udvide repræsentationen i lokal kampagnefinansiering?
- Hvordan ville dage og nætter blive påvirket, hvis jorden var flad?
- Hvordan forbliver energi konstant under frit fald?


