Hvad fortalte guldfolieeksperiment dem om atomet?
1. Atomet er for det meste tomt rum: De fleste af alfa -partiklerne, der blev fyret mod guldfolien, passerede lige igennem, hvilket antyder, at atomet for det meste er tomt rum.
2. Der findes en tæt, positivt ladet kerne: En lille brøkdel af alfa -partiklerne blev afbøjet i store vinkler, og nogle sprang endda tilbage. Dette indikerede tilstedeværelsen af et tæt, positivt ladet område inden for atomet, som Rutherford kaldte kernen.
3. Kernen er lille: Det faktum, at kun et lille antal alfa -partikler blev afbøjet antydede, at kernen optager et meget lille volumen sammenlignet med atomets samlede størrelse.
4. Elektroner kredser om kernen: Baseret på eksperimentets resultater foreslog Rutherford en model, hvor elektroner kredsede om kernen som planeter omkring solen. Denne model blev imidlertid senere forfinet, da den ikke kunne forklare atomets stabilitet.
Nøgle takeaways:
* Guldfolieeksperimentet leverede det første direkte bevis for eksistensen af atomkernen.
* Det konstaterede, at atomet ikke er en solid sfære, men snarere en struktur med et koncentreret, positivt ladet center omgivet af en sky af negativt ladede elektroner.
* Dette eksperiment førte til udviklingen af atomets nukleare model, som er blevet yderligere raffineret og udvidet over tid.
Sammenfattende ændrede guldfolieeksperimentet grundlæggende vores forståelse af atomet fra en solid, udelelig sfære til en kompleks struktur med en lille, tæt kerne i midten.
Sidste artikelHvad er funktionel komplementering?
Næste artikelHvad er de 5 divisioner af kemi og deres betydning?
 Varme artikler
Varme artikler
-
 Video:Hvordan regner det plastik ?!Kredit:The American Chemical Society Hvert år, mere end 1, 000 tons plastikregn ned på nationalparker og vildmarksområder i det vestlige USA I denne uges afsnit, vi taler om, hvor den plast komme
Video:Hvordan regner det plastik ?!Kredit:The American Chemical Society Hvert år, mere end 1, 000 tons plastikregn ned på nationalparker og vildmarksområder i det vestlige USA I denne uges afsnit, vi taler om, hvor den plast komme -
 Klarhed nødvendig i klassificeringssystemer til forarbejdede fødevarerKredit:Pixabay/CC0 Public Domain Nuværende fødevareklassifikationssystemer for forarbejdede fødevarer mangler konsistens og konsensus, der ofte fører til forvirring og debat, selv blandt forskere,
Klarhed nødvendig i klassificeringssystemer til forarbejdede fødevarerKredit:Pixabay/CC0 Public Domain Nuværende fødevareklassifikationssystemer for forarbejdede fødevarer mangler konsistens og konsensus, der ofte fører til forvirring og debat, selv blandt forskere, -
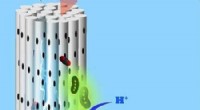 Hjælpsomme mikrober indånder kuldioxid gennem en porøs cylindrisk elektrode og udstråler nyttige…Mikrober, der vokser på porøse cylindriske elektroder, suger CO2 ind og omdanner det til nyttige kemikalier såsom acetat og metan. © 2018 Bin Bian Mikrober kan blive nøgleallierede i globale bestr
Hjælpsomme mikrober indånder kuldioxid gennem en porøs cylindrisk elektrode og udstråler nyttige…Mikrober, der vokser på porøse cylindriske elektroder, suger CO2 ind og omdanner det til nyttige kemikalier såsom acetat og metan. © 2018 Bin Bian Mikrober kan blive nøgleallierede i globale bestr -
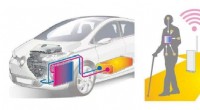 Skønhed i ufuldkommenhed:Hvordan krystaldefekter kan hjælpe med at omdanne spildvarme til elektric…Eksempler på anvendelser af elproduktion ved hjælp af termoelektrisk konvertering. Det involverer konvertering af udstødningsvarme fra bilmotorer til elektricitet til genbrug, eller bruge forskellen i
Skønhed i ufuldkommenhed:Hvordan krystaldefekter kan hjælpe med at omdanne spildvarme til elektric…Eksempler på anvendelser af elproduktion ved hjælp af termoelektrisk konvertering. Det involverer konvertering af udstødningsvarme fra bilmotorer til elektricitet til genbrug, eller bruge forskellen i
- Vands rolle i økosystemet
- Gaming-appen har til formål at lære millioner af amerikanske voksne, der ikke kan læse
- Olympiske medaljer i 2020 fremstilles af genanvendte telefoner
- Fremskridt i undersøgelsen af ultrahurtig elektrondynamik ved hjælp af korte lysimpulser
- Kvantedans i takt med en tromme:Forskere observerer, hvordan energien i en enkelt elektron er indsti…
- Undersøgelse viser, at folk foretrækker at donere tid - selv når velgørende organisationer taber


