Hvilket tryk udøves med 743,3 g CH4 i en 0,850 L stålbeholder ved 145,7 K?
1. Konverter gram af CH4 til mol:
* Molmasse af CH4 =12,01 g/mol (c) + 4 * 1,01 g/mol (H) =16,05 g/mol
* Mol CH4 =743,3 g / 16,05 g / mol =46,32 mol
2. Brug den ideelle gaslov:
* Den ideelle gaslov er: pv =nrt
* P =pres (i atmosfærer)
* V =volumen (i liter)
* n =antal mol
* R =ideel gaskonstant (0,0821 l · atm/mol · k)
* T =temperatur (i Kelvin)
3. Løs for pres (p):
* P =(nrt) / v
* P =(46,32 mol * 0,0821 L · ATM / mol · K * 145,7 K) / 0,850 L
* P ≈ 837 atm
Derfor er det tryk, der udøves med 743,3 g CH4 i en 0,850 L stålbeholder ved 145,7 K, ca. 837 atm.
Sidste artikelHvad er overfladetrykket på Merkur?
Næste artikelHvad bliver skrevet til en kemisk reaktion, når den er afbalanceret?
 Varme artikler
Varme artikler
-
 On-chip lægemiddelscreening til identifikation af antibiotikainteraktioner på otte timerBagsidebillede til Lab on a Chip. Kredit:Korea Advanced Institute of Science and Technology (KAIST) Et KAIST-forskerhold udviklede en mikrofluidbaseret lægemiddelscreeningschip, der identificerer
On-chip lægemiddelscreening til identifikation af antibiotikainteraktioner på otte timerBagsidebillede til Lab on a Chip. Kredit:Korea Advanced Institute of Science and Technology (KAIST) Et KAIST-forskerhold udviklede en mikrofluidbaseret lægemiddelscreeningschip, der identificerer -
 Betonstrukturenes levetid forlænges med et kulstoftekstil(Venstre) Forringet betonelement og præfabrikeret TRM -panel; og (højre) Betonelement forstærket med TRM -panel. Kredit:Korea Institute of Civil Engineering and Building Technology (KICT) Korea In
Betonstrukturenes levetid forlænges med et kulstoftekstil(Venstre) Forringet betonelement og præfabrikeret TRM -panel; og (højre) Betonelement forstærket med TRM -panel. Kredit:Korea Institute of Civil Engineering and Building Technology (KICT) Korea In -
 Blæksprutteskind inspirerer til skabelsen af næste generations rumtæppeAlon Gorodetsky, UCI lektor i kemisk og biomolekylær teknik, og Erica Leung, en UCI kandidatstuderende i den afdeling, har opfundet et nyt materiale, der kan fange eller frigive varme efter ønske. Kre
Blæksprutteskind inspirerer til skabelsen af næste generations rumtæppeAlon Gorodetsky, UCI lektor i kemisk og biomolekylær teknik, og Erica Leung, en UCI kandidatstuderende i den afdeling, har opfundet et nyt materiale, der kan fange eller frigive varme efter ønske. Kre -
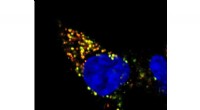 Sortering og udskillelse af insulin efter udløbsdatoForskere tog dette billede af en insulin-udskillende celle fra en mus ved hjælp af en teknik til at mærke insulin granulat, efter alder. I yngre granulater, markøren udsender et grønt fluorescerende l
Sortering og udskillelse af insulin efter udløbsdatoForskere tog dette billede af en insulin-udskillende celle fra en mus ved hjælp af en teknik til at mærke insulin granulat, efter alder. I yngre granulater, markøren udsender et grønt fluorescerende l
- Forskere opdager polære Bloch-punkter i anstrengte ferroelektriske film
- Geovidenskabsekspert for at undersøge, hvorfor kontinenter går i stykker, hvor der mangler magma
- Er bagepulver en god elektrisk leder?
- Tre grunde til, at et svagt pund er dårligt nyt for miljøet
- Anvendelse af kompost på lossepladser kan have miljømæssige fordele
- Gør tilføjelse af vand til en base pH -værdien højere eller lavere?


