Er hydrogenbinding er en stærk attraktiv kraft.?
Her er hvorfor:
* stærkere end dipol-dipol-interaktioner: Hydrogenbindinger opstår fra den specielle interaktion mellem et hydrogenatom kovalent bundet til et stærkt elektronegativt atom (som ilt, nitrogen eller fluor) og et ensomt par elektroner på et andet elektronegativt atom. Dette skaber en stærk elektrostatisk attraktion.
* svagere end kovalente obligationer: Mens hydrogenbindinger er stærkere end typiske dipol-dipol-interaktioner, er de stadig markant svagere end kovalente bindinger. Dette skyldes, at de involverer deling af elektroner mellem atomer, mens brintbindinger primært er elektrostatiske interaktioner.
Her er en nyttig analogi:
Forestil dig en stærk magnet (kovalent binding) med to metalstykker sammen. Forestil dig nu en svagere magnet (brintbinding), der tiltrækker to stykker metal, men ikke holder dem sammen så tæt.
Betydningen af hydrogenbinding:
På trods af at de er svagere end kovalente bindinger, er brintbindinger afgørende for mange biologiske og kemiske processer, herunder:
* Vandegenskaber: Hydrogenbindinger er ansvarlige for vandets høje kogepunkt, overfladespænding og evne til at fungere som et opløsningsmiddel.
* Proteinstruktur: Hydrogenbindinger spiller en afgørende rolle for at opretholde proteinernes form og funktion.
* DNA -struktur: Hydrogenbindinger holder de to DNA -tråde sammen, hvilket muliggør replikation og transkription.
Så selvom brintbindinger ikke er de stærkeste kræfter, er de stadig vigtige for mange vigtige biologiske og kemiske processer.
 Varme artikler
Varme artikler
-
 Teoretisk forudsigelse af omvendt intersystemkrydsning for organiske halvledereKredit:CC0 Public Domain Et fælles forskerhold ved RIKEN og Hokkaido University udviklede en metode til at forudsige hastighedskonstanter for reverse intersystem crossing (RISC) forbundet med lyse
Teoretisk forudsigelse af omvendt intersystemkrydsning for organiske halvledereKredit:CC0 Public Domain Et fælles forskerhold ved RIKEN og Hokkaido University udviklede en metode til at forudsige hastighedskonstanter for reverse intersystem crossing (RISC) forbundet med lyse -
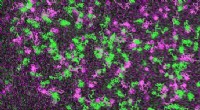 Forskere observerer individuelle cellulære receptorer på arbejdeSamtidig visualisering og sporing af individuelle receptorer (grøn) og G -proteiner (magenta) på overfladen af en levende celle. Receptorerne og G -proteiner gennemgår forbigående interaktioner, som
Forskere observerer individuelle cellulære receptorer på arbejdeSamtidig visualisering og sporing af individuelle receptorer (grøn) og G -proteiner (magenta) på overfladen af en levende celle. Receptorerne og G -proteiner gennemgår forbigående interaktioner, som -
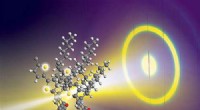 Nye strukturelle detaljer om det specifikke arrangement af atomer i konjugerede polymererKredit:Journal of the American Chemical Society cover Avancerede røntgenteknikker har afsløret nye strukturelle detaljer om det specifikke arrangement af atomer i konjugerede polymerer, en vigtig
Nye strukturelle detaljer om det specifikke arrangement af atomer i konjugerede polymererKredit:Journal of the American Chemical Society cover Avancerede røntgenteknikker har afsløret nye strukturelle detaljer om det specifikke arrangement af atomer i konjugerede polymerer, en vigtig -
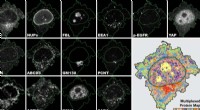 Ny metode forfiner celleprøveanalyse4i er den første billeddannelsesteknik, som giver os en multiplekset væv-til-organel-visning af biologiske prøver og forbinder flere oplysninger i et og samme eksperiment. Kredit:UZH Forskere ved
Ny metode forfiner celleprøveanalyse4i er den første billeddannelsesteknik, som giver os en multiplekset væv-til-organel-visning af biologiske prøver og forbinder flere oplysninger i et og samme eksperiment. Kredit:UZH Forskere ved
- Kan træer kontrollere algeopblomstring?
- Venner påvirker mellemskoleelevers holdninger til jævnaldrende af forskellige etniciteter, løb
- Hvor står solen op og solen går ned?
- Hvor kom ingredienserne i den sandwich fra? Vores globale næringsstoftracker fortæller en kompleks…
- Hvordan definerer man et ur?
- Sådan konverteres et decimal til timer og minutter


