Hvor mange mol vand er produceret, når 45,3 brint reagerer med ilt?
1. Skriv den afbalancerede kemiske ligning:
2 H₂ + O₂ → 2 H₂O
Denne ligning fortæller os, at 2 mol brint (H₂) reagerer med 1 mol ilt (O₂) for at producere 2 mol vand (H₂O).
2. Bestem den begrænsende reaktant:
Vi er nødt til at vide, hvor meget ilt der er til stede for at bestemme den begrænsende reaktant. Den begrænsende reaktant er det stof, der først bliver brugt op og begrænser mængden af dannet produkt. Da mængden af ilt ikke er givet, kan vi ikke bestemme den begrænsende reaktant.
3. Beregn mol produceret vand (forudsat overskydende ilt):
* Antag overskydende ilt: Hvis der er et overskud af ilt, vil mængden af brint begrænse mængden af produceret vand.
* Konverter gram brint til mol: Du skal slå op den molære masse af brint (H₂), som er ca. 2 g/mol.
* mol H₂ =(45,3 g H₂) / (2 g / mol H₂) =22,65 mol H₂
* Brug molforholdet fra den afbalancerede ligning:
* Ligningen viser 2 mol H₂, der producerer 2 mol H₂O. Dette betyder, at molforholdet er 1:1.
* Beregn mol vand:
* mol H₂O =22,65 mol H₂ * (2 mol H₂O / 2 mol H₂) =22,65 mol H₂O
Konklusion:
Hvis der er et overskud af ilt, vil 45,3 gram brint producere 22,65 mol vand.
Vigtig note: Hvis du har en bestemt mængde ilt, skal du bruge disse oplysninger til at beregne den begrænsende reaktant og bestemme den faktiske mængde vand, der er produceret.
Sidste artikelHvad giver strontiumchlorid og natriumsulfat?
Næste artikelHvad skete der, når alkalimetaller reagerer med ammoniak?
 Varme artikler
Varme artikler
-
 Raketbrændstof, der er renere, sikrere og stadig fuld af energiKredit:CC0 Public Domain Forskning offentliggjort i denne uge i Videnskabens fremskridt viser, at det måske er muligt at skabe raketbrændstof, der er meget renere og sikrere end de hypergoliske
Raketbrændstof, der er renere, sikrere og stadig fuld af energiKredit:CC0 Public Domain Forskning offentliggjort i denne uge i Videnskabens fremskridt viser, at det måske er muligt at skabe raketbrændstof, der er meget renere og sikrere end de hypergoliske -
 Appellerende fund tyder på, hvorfor køling dæmper bananaromaerKredit:American Chemical Society Bananer er en af verdens mest populære frugter. Men hvordan de opbevares, før de når dagligvarehylderne, kan påvirke deres smag og lugt negativt. Nu i en undersø
Appellerende fund tyder på, hvorfor køling dæmper bananaromaerKredit:American Chemical Society Bananer er en af verdens mest populære frugter. Men hvordan de opbevares, før de når dagligvarehylderne, kan påvirke deres smag og lugt negativt. Nu i en undersø -
 Bottom-up syntese af krystallinske 2-D polymererKredit:CC0 Public Domain Forskere ved Center for Advancing Electronics Dresden (cfaed) ved TU Dresden er lykkedes med at syntetisere arklignende 2-D-polymerer ved en bottom-up-proces for første ga
Bottom-up syntese af krystallinske 2-D polymererKredit:CC0 Public Domain Forskere ved Center for Advancing Electronics Dresden (cfaed) ved TU Dresden er lykkedes med at syntetisere arklignende 2-D-polymerer ved en bottom-up-proces for første ga -
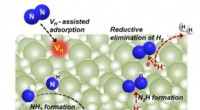 Overgangsmetalfrit bariumhydrid medierer dinitrogenfiksering og ammoniaksynteseOvergangsmetalfri dinitrogenfiksering medieret af bariumhydrid. Kredit:Guan Yeqin Ammoniak er afgørende for fremstillingen af kvælstofgødning. På grund af det høje energiforbrug ved industriel am
Overgangsmetalfrit bariumhydrid medierer dinitrogenfiksering og ammoniaksynteseOvergangsmetalfri dinitrogenfiksering medieret af bariumhydrid. Kredit:Guan Yeqin Ammoniak er afgørende for fremstillingen af kvælstofgødning. På grund af det høje energiforbrug ved industriel am
- Hvad er NDRRMC eller NDRRO?
- Hvorfor går flere politikere ikke på pension? Ekspert forklarer, hvordan USA kan drage fordel af e…
- Læser fysikken, der gemmer sig i data
- Sådan beregnes radius af en kurve
- Stigende havtemperaturer truer strandengene og deres evne til at holde kulstof
- Bankers tonefald kan øge aktiemarkederne og dulme investorernes frygt


