Hvordan er en isotop af et atom, der er anderledes end ikke -isotop?
isotop vs. ikke-isotop
* isotoper: Dette er atomer med det samme element, der har det samme antal protoner (og dermed det samme atomnummer), men et andet antal neutroner. Dette betyder, at de har forskellige atommasser.
* Eksempel: Carbon-12, carbon-13 og carbon-14 er alle isotoper af kulstof. De har alle 6 protoner, men de har henholdsvis 6, 7 og 8 neutroner.
* ikke-isotop: Dette udtryk bruges ikke rigtig i kemi. Et atom, der ikke er en isotop, er simpelthen et atom af et bestemt element. Det er nyttigt at tænke på det på denne måde:hvert atom i et element er en ikke-isotop, medmindre det specifikt identificeres som en isotop (som carbon-14).
nøglepunkter at huske
* atomnummer: Antallet af protoner i et atoms kerne definerer elementet. Alle atomer med det samme element har det samme atomnummer.
* Massenummer: Summen af protoner og neutroner i en atoms kerne. Isotoper adskiller sig i deres massetal på grund af det varierende antal neutroner.
Kort sagt:
* isotoper er variationer af det samme element, der kun adskiller sig i deres neutronantal og dermed deres masse.
* ikke-isotoper er simpelthen atomer af et specifikt element uden nogen særlig betegnelse vedrørende neutronnummer.
Fortæl mig, hvis du har andre spørgsmål!
Sidste artikelHvad er de vigtigste faktorer, der påvirker reaktionshastighederne?
Næste artikelHvad er en blyion?
 Varme artikler
Varme artikler
-
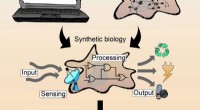 Biologiske signalprocesser i intelligente materialerKredit:Albert-Ludwigs-Universität Freiburg Forskere fra University of Freiburg har udviklet materialesystemer, der er sammensat af biologiske komponenter og polymermaterialer og er i stand til at
Biologiske signalprocesser i intelligente materialerKredit:Albert-Ludwigs-Universität Freiburg Forskere fra University of Freiburg har udviklet materialesystemer, der er sammensat af biologiske komponenter og polymermaterialer og er i stand til at -
 Små skæl kan tjene som sikkert materiale i implantater til at forstærke knogler og ledEt scanningselektronmikroskopbillede viser de kunstige skæl, ” omkring et dusin af dem kunne passe på tværs af punktum i slutningen af en sætning. Kredit:Tian lab/University of Chicago Vægt er d
Små skæl kan tjene som sikkert materiale i implantater til at forstærke knogler og ledEt scanningselektronmikroskopbillede viser de kunstige skæl, ” omkring et dusin af dem kunne passe på tværs af punktum i slutningen af en sætning. Kredit:Tian lab/University of Chicago Vægt er d -
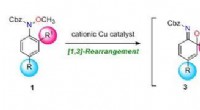 Effektiv syntese af multisubstituerede aniliner ved domino-omlejringMultisubstituerede aniliner (ortho-anisidiner). Kredit:Tohoku University Aniliner er blevet meget brugt i medicin, især i acetaminophen smertestillende midler. De bruges også i organiske materiale
Effektiv syntese af multisubstituerede aniliner ved domino-omlejringMultisubstituerede aniliner (ortho-anisidiner). Kredit:Tohoku University Aniliner er blevet meget brugt i medicin, især i acetaminophen smertestillende midler. De bruges også i organiske materiale -
 Designerbakterier producerer koralantibiotikaHornkoraller af arten Antillogorgia elisabethae producerer antibiotiske naturlige stoffer. Et forskerhold på TUM har med succes produceret et af disse stoffer i laboratoriet. Kredit:Thomas Brück/TUM
Designerbakterier producerer koralantibiotikaHornkoraller af arten Antillogorgia elisabethae producerer antibiotiske naturlige stoffer. Et forskerhold på TUM har med succes produceret et af disse stoffer i laboratoriet. Kredit:Thomas Brück/TUM
- Forskere kaster nyt lys over gopher-skildpadder
- Hvad er et område med jord, der er mindre end et kontinent og fuldstændigt omgivet af vand?
- Evolutionens brændstof:En ny hypotese om, hvordan komplekst liv opstod på Jorden
- Dataanalyse i en krisetid:Hvordan virksomheder kan navigere i de kommende måneder
- Har stjernebilledet pegasus mere end ét navn?
- Ny undersøgelse viser stressreaktion i realtid på racisme


