Hvad er de vigtigste faktorer, der påvirker reaktionshastighederne?
1. Koncentration af reaktanter:
* Højere koncentration: Flere reaktantmolekyler er til stede, hvilket fører til hyppigere kollisioner og derfor hurtigere reaktioner.
2. Temperatur:
* Højere temperatur: Molekyler bevæger sig hurtigere og kolliderer hyppigere med højere energi, hvilket øger sandsynligheden for vellykkede kollisioner og dermed hurtigere reaktioner.
3. Overfladeareal:
* større overfladeareal: Mere overfladeareal for reaktanter til at interagere, hvilket fører til flere kollisioner og hurtigere reaktioner. Dette er især vigtigt for reaktioner, der involverer faste stoffer.
4. Katalysatorer:
* tilstedeværelse af katalysatorer: Katalysatorer fremskynder reaktioner ved at tilvejebringe en alternativ reaktionsvej med lavere aktiveringsenergi uden at blive konsumeret i processen.
5. Reaktanters art:
* forskellige kemiske bindinger: Nogle kemiske bindinger er lettere at bryde end andre, der påvirker reaktionshastighederne.
* Fysisk tilstand: Reaktioner i væske- eller gasfasen er generelt hurtigere end dem i den faste fase på grund af større mobilitet af molekyler.
6. Tryk (til gasfase-reaktioner):
* Højere pres: Flere reaktantmolekyler er pakket i et givet volumen, hvilket øger hyppigheden af kollisioner og fører til hurtigere reaktioner.
7. Aktiveringsenergi:
* Nedre aktiveringsenergi: Den minimale energi, der kræves for at en reaktion kan forekomme. Reaktioner med lavere aktiveringsenergi fortsætter hurtigere, fordi flere molekyler har nok energi til at reagere.
8. Lys (til fotokemiske reaktioner):
* Tilstedeværelse af lys: Nogle reaktioner kræver lys for at starte reaktionen. Intensiteten og bølgelængden af lys kan påvirke hastigheden for disse reaktioner.
Det er vigtigt at bemærke, at disse faktorer ofte kan arbejde i kombination for at påvirke reaktionshastighederne. For eksempel vil forøgelse af koncentrationen af reaktanter og temperaturen begge øge reaktionshastigheden markant.
Sidste artikelHvor mange atomer er der i Mg (OH2) 3?
Næste artikelHvordan er en isotop af et atom, der er anderledes end ikke -isotop?
 Varme artikler
Varme artikler
-
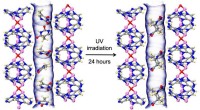 Ny biologisk afledt metal-organisk ramme efterligner DNASION-19, en biologisk afledt MOF baseret på adenin blev brugt til at låse Thymin (Thy) molekyler i kanalerne gennem hydrogenbindingsinteraktioner mellem adenin og thymin. Ved bestråling, thyminmolekyl
Ny biologisk afledt metal-organisk ramme efterligner DNASION-19, en biologisk afledt MOF baseret på adenin blev brugt til at låse Thymin (Thy) molekyler i kanalerne gennem hydrogenbindingsinteraktioner mellem adenin og thymin. Ved bestråling, thyminmolekyl -
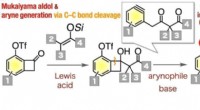 En dejlig reaktiv ring til det:Nye syntetiske veje til forskellige aromatiske forbindelserMukaiyama aldol-reaktionen af 6-(triflyloxy)benzocyclobutenoner med ketensilylacetaler og efterfølgende generering af aryner af γ-aryl-β-ketoester-type fra resulterende 6-(triflyloxy)benzocyclobuten
En dejlig reaktiv ring til det:Nye syntetiske veje til forskellige aromatiske forbindelserMukaiyama aldol-reaktionen af 6-(triflyloxy)benzocyclobutenoner med ketensilylacetaler og efterfølgende generering af aryner af γ-aryl-β-ketoester-type fra resulterende 6-(triflyloxy)benzocyclobuten -
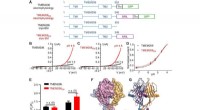 Kryo-elektronmikroskopisk struktur af en protonaktiveret kloridkanal ved navn TMEM206Funktion og struktur af pufferfish TMEM206. (A) Skematisk af kanalkonstruktioner, der anvendes til elektrofysiologi og enkeltpartikel-kryo-EM-eksperimenter. Thr repræsenterer et thrombin-spaltningsste
Kryo-elektronmikroskopisk struktur af en protonaktiveret kloridkanal ved navn TMEM206Funktion og struktur af pufferfish TMEM206. (A) Skematisk af kanalkonstruktioner, der anvendes til elektrofysiologi og enkeltpartikel-kryo-EM-eksperimenter. Thr repræsenterer et thrombin-spaltningsste -
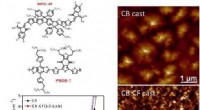 Binær opløsningsmiddelblanding, der øger høj effektivitet af polymersolcellerDe kemiske strukturer af elektrondonor PBDB-T og fluoreret NFA INPIC-4F; J-V karakteristika for PBDB-T:INPIC-4F solceller støbt af forskellige opløsningsmidler; AFM-billederne af PBDB-T:INPIC-4F overf
Binær opløsningsmiddelblanding, der øger høj effektivitet af polymersolcellerDe kemiske strukturer af elektrondonor PBDB-T og fluoreret NFA INPIC-4F; J-V karakteristika for PBDB-T:INPIC-4F solceller støbt af forskellige opløsningsmidler; AFM-billederne af PBDB-T:INPIC-4F overf
- Styrket af politikker, chartre adskiller skoler
- Hvordan Twitter hjalp Trump med at vinde det amerikanske valg
- Spor mængder isotop fra Fukushima -katastrofen fundet i Californiens vin
- AC & DC Egenskaber
- Redaktionelt:Hvor slem klimakrisen bliver, er stadig op til os – vi skal bare handle
- Rester af kvinde fra 800 år siden fundet i kano begravet i det nordvestlige Patagonien


