Hvad gør den sats, der bruges til at bestemme en reaktion?
* rækkefølgen af reaktionen: Dette henviser til, hvordan reaktionshastigheden ændres, når koncentrationen af hver reaktant ændres. Ordren med hensyn til en bestemt reaktant er eksponenten for dens koncentrationsperiode i hastighedsloven. For eksempel, hvis renteloven er:
Hastighed =k [a]^2 [b]
Derefter er reaktionen anden orden med hensyn til en og første orden med hensyn til B. Den samlede rækkefølge af reaktionen er summen af de individuelle ordrer (i dette tilfælde 2 + 1 =3).
* hastighedskonstanten (k): Dette er en proportionalitetskonstant, der relaterer reaktionshastigheden på koncentrationerne af reaktanterne. Værdien af K er specifik for en bestemt reaktion ved en given temperatur.
* Effekten af ændrede koncentrationer på hastigheden: Ved at tilslutte forskellige koncentrationer af reaktanter i hastighedsloven kan vi forudsige, hvordan reaktionshastigheden vil ændre sig.
* reaktionsmekanismen: Mens hastighedsloven ikke direkte afslører den komplette mekanisme, giver den værdifuld information om, hvilke trin i mekanismen, der er langsomme (hastighedsbestemmende), og hvilke der er hurtige.
her er en simpel analogi:
Forestil dig et billøb. Hastighedsloven er som ligningen, der fortæller dig, hvor hurtigt bilerne går baseret på faktorer som hestekræfter på motoren (reaktantkoncentration) og sporets tilstand (temperatur).
Nøglepunkter om satsens lov:
* Det bestemmes eksperimentelt, ikke teoretisk.
* Det er specifikt for en bestemt reaktion.
* Det fortæller os ikke noget om reaktionsmekanismen, kun på hastigheden.
* Hastighedsloven er et kraftfuldt værktøj til at forstå og forudsige opførelsen af kemiske reaktioner.
Sidste artikelEr sand et ikke -metal eller metal?
Næste artikelHvordan adlyder metaller Lewis Octet -reglen?
 Varme artikler
Varme artikler
-
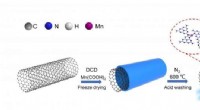 Mangan-enkeltatom-katalysator øger ydeevnen af elektrokemisk reduktion af kuldioxidSkematisk diagram af Mn SAC-fremstilling og mekanisme for elektrokemisk CO 2 reduktion. Kredit:FENG jiaqi Elektrokemisk CO 2 reduktionsreaktion (CO 2 RR) er en lovende tilgang til at omdanne
Mangan-enkeltatom-katalysator øger ydeevnen af elektrokemisk reduktion af kuldioxidSkematisk diagram af Mn SAC-fremstilling og mekanisme for elektrokemisk CO 2 reduktion. Kredit:FENG jiaqi Elektrokemisk CO 2 reduktionsreaktion (CO 2 RR) er en lovende tilgang til at omdanne -
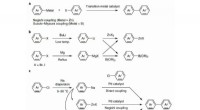 Kemikere viser, at natrium sikkert kan bruges til krydskoblingsreaktionerFremstilling af organometalliske forbindelser og de efterfølgende krydskoblingsreaktioner. en, Overgangsmetal-katalyserede krydskoblingsreaktioner. b, Almindelige metoder til fremstilling af organozin
Kemikere viser, at natrium sikkert kan bruges til krydskoblingsreaktionerFremstilling af organometalliske forbindelser og de efterfølgende krydskoblingsreaktioner. en, Overgangsmetal-katalyserede krydskoblingsreaktioner. b, Almindelige metoder til fremstilling af organozin -
 Kemikere får et glimt af en reaktions flygtige overgangstilstandKredit:CC0 Public Domain Under en kemisk reaktion, molekylerne involveret i reaktionen får energi, indtil de når et point of no return, kendt som en overgangstilstand. Indtil nu, ingen har skimte
Kemikere får et glimt af en reaktions flygtige overgangstilstandKredit:CC0 Public Domain Under en kemisk reaktion, molekylerne involveret i reaktionen får energi, indtil de når et point of no return, kendt som en overgangstilstand. Indtil nu, ingen har skimte -
 Elektrokemiske celler høster lithium fra havvandKAUST-forskere har udviklet en metode til at udvinde lithium, et vigtigt element i batterier til autonome køretøjer, fra havvand på en mere økonomisk rentabel måde. Kredit:Morgan Bennett Smith Lit
Elektrokemiske celler høster lithium fra havvandKAUST-forskere har udviklet en metode til at udvinde lithium, et vigtigt element i batterier til autonome køretøjer, fra havvand på en mere økonomisk rentabel måde. Kredit:Morgan Bennett Smith Lit
- Stigende havniveauer skaber de første indianske klimaflygtninge
- Hjemmelavet batteri Tester
- Hvad kaldes Big Bang -teorien i Big Bang?
- Opnå UV -ikke -linearitet med en bred båndgab halvlederbølgeleder
- Kraftige følelser påvirker, hvordan vælgere søger politisk information
- Sådan finder du basen i en højre trekant


