Hvordan adlyder metaller Lewis Octet -reglen?
* Elektronkonfiguration: Metaller har en tendens til at have få valenselektroner (elektroner i den yderste skal). De opnår stabilitet ved at miste disse elektroner for at danne positive ioner (kationer).
* octet regel: Octet -reglen siger, at atomer har en tendens til at vinde, miste eller dele elektroner for at opnå en stabil konfiguration af otte elektroner i deres yderste skal.
* Undtagelser: Metaller som natrium (NA) og kalium (K) har kun en valenselektron. At miste dette elektron giver dem en fuld ydre skal, men det er ikke en oktet. Tilsvarende opnår magnesium (Mg) og calcium (CA) med to valenselektroner stabilitet med to færre elektroner end en oktet.
Eksempel: Natrium (NA) har en valenselektron. Når den mister denne elektron, danner den en Na+ -ion med elektronkonfigurationen af neon (NE), som har en fuld ydre skal af otte elektroner. Dette følger dog ikke octetreglen, fordi Na+ -ionen kun har 2 elektroner i sin yderste skal.
I stedet for Octet -reglen følger metaller følgende:
* Elektropositivitet: Metaller har en tendens til at være elektropositive, hvilket betyder, at de har en stærk tendens til at miste elektroner. Dette skyldes deres lave ioniseringsenergi.
* Dannelse af kationer: Ved at miste elektroner opnår metaller en stabil konfiguration med en fuld eller delvist fyldt lavere energi -shell, hvilket resulterer i dannelsen af positive ioner.
Bemærk: Overgangsmetaller er et specielt tilfælde og har ofte flere oxidationstilstande, hvilket betyder, at de kan miste det forskellige antal elektroner. Deres elektronkonfigurationer er mere komplekse, og de følger heller ikke altid Octet -reglen.
Kortfattet: Mens metaller ikke strengt følger oktetreglen, opnår de stabilitet ved at miste elektroner til at danne kationer med en fuld eller delvist fyldt lavere energi -skal. Dette er et nøglebegreb i forståelsen af den kemiske opførsel af metaller.
Sidste artikelHvad gør den sats, der bruges til at bestemme en reaktion?
Næste artikelHvad sker der, når du blander diamant med titanium?
 Varme artikler
Varme artikler
-
 Ny katalysator opgraderer drivhusgas til vedvarende kulbrinterDr. Cao-Thang Dinh, venstre, og Dr. Md Golam Kibria demonstrerer deres nye katalysator. I et papir offentliggjort i dag i Science, deres team demonstrerede den mest effektive og stabile proces til at
Ny katalysator opgraderer drivhusgas til vedvarende kulbrinterDr. Cao-Thang Dinh, venstre, og Dr. Md Golam Kibria demonstrerer deres nye katalysator. I et papir offentliggjort i dag i Science, deres team demonstrerede den mest effektive og stabile proces til at -
 Afkodning af en nøgledel af cellen atom for atomKredit:Valerie Altounian Uanset hvad du laver, om det er at køre bil, gå en løbetur eller endda på din dovneste måde, spise chips og se tv på sofaen, er der en hel suite af molekylært maskineri ind
Afkodning af en nøgledel af cellen atom for atomKredit:Valerie Altounian Uanset hvad du laver, om det er at køre bil, gå en løbetur eller endda på din dovneste måde, spise chips og se tv på sofaen, er der en hel suite af molekylært maskineri ind -
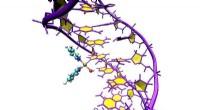 Hvordan interagerer metaller med DNA?Computersimuleringer viser den præcise placering af Pt103 i DNA. Kredit:Juan J. Nogueira, Universitetet i Wien I et par årtier, metalholdige lægemidler er med succes blevet brugt til at bekæmpe vi
Hvordan interagerer metaller med DNA?Computersimuleringer viser den præcise placering af Pt103 i DNA. Kredit:Juan J. Nogueira, Universitetet i Wien I et par årtier, metalholdige lægemidler er med succes blevet brugt til at bekæmpe vi -
 Porøse polymerfilm med formhukommelseKredit:Wiley Uanset om det er til separationsprocesser, solcelleanlæg, katalyse, eller elektronik, porøse polymermembraner er nødvendige på mange områder. Membraner med mikroporer, der skifter mel
Porøse polymerfilm med formhukommelseKredit:Wiley Uanset om det er til separationsprocesser, solcelleanlæg, katalyse, eller elektronik, porøse polymermembraner er nødvendige på mange områder. Membraner med mikroporer, der skifter mel
- Space Rider:Europas genanvendelige rumtransportsystem
- Forskere udvikler nye optiske kredsløbskomponenter til at manipulere lys
- Euclid-rumfartøjet vil transformere, hvordan vi ser det 'mørke univers'
- Er vi alle martians?
- Magnetiske felter i bevægelse forstyrrer iskernen
- At gøre op med essays stopper ikke nødvendigvis elevers snyd


