Analyse af organiske forbindelser baseret på UV -spektre?
Analyse af organiske forbindelser baseret på UV -spektre:et dybt dykk
UV -spektroskopi er et kraftfuldt værktøj til analyse af organiske forbindelser, der giver værdifulde oplysninger om deres struktur og elektroniske overgange. Her er en oversigt over de vigtigste principper og applikationer:
1. Fundamentals of UV -spektroskopi:
* UV -stråling og elektroniske overgange: UV -stråling begejstrer elektroner i organiske molekyler fra deres jordtilstand til højere energiniveau. Denne proces er kendt som elektronisk excitation. De specifikke bølgelængder, der er absorberet, afhænger af energiforskellen mellem jorden og ophidsede tilstande.
* kromoforer: Dette er funktionelle grupper, der absorberer UV -stråling og forårsager de elektroniske overgange. De involverer typisk konjugerede systemer, såsom dobbeltbindinger, aromatiske ringe, carbonylgrupper og heteroatomer.
* auxochromes: Dette er grupper, der ikke absorberer UV -stråling selv, men de kan forbedre absorptionen af kromoforer ved at skifte absorptionsmaksimum til længere bølgelængder (badokromisk skift) og øge intensiteten af absorptionen (hyperchromisk skift).
2. Fortolkning af UV -spektre:
* λmax: Den bølgelængde, hvormed maksimal absorption forekommer, kaldes λmax. Det er en karakteristisk egenskab ved en specifik kromofor og påvirkes af faktorer som typen af kromofor, konjugering og opløsningsmiddeleffekter.
* molaborptivitet (ε): Denne parameter måler styrken af absorption ved en bestemt bølgelængde. Det er direkte relateret til koncentrationen af analytten og sti -længden af UV -strålen.
* spektrefunktioner: Analyse af formen og placeringen af toppe og truger i UV -spektret hjælper med at identificere tilstedeværelsen og arten af specifikke funktionelle grupper og deres interaktioner inden for molekylet.
3. Anvendelser af UV -spektroskopi:
* Identifikation og karakterisering: UV -spektre kan hjælpe med at skelne mellem forskellige organiske forbindelser baseret på deres unikke absorptionsprofiler.
* Kvantitativ analyse: Ved at anvende øl-Lamberts lov kan UV-spektroskopi bruges til at bestemme koncentrationen af en kendt analyt i en prøve.
* Strukturbelystelse: Tilstedeværelsen og positionen af absorptionsbånd kan give information om tilstedeværelsen af kromoforer, graden af konjugering og den mulige tilstedeværelse af visse funktionelle grupper.
* Reaktionsovervågning: UV -spektroskopi kan spore fremskridt med reaktioner ved at overvåge ændringer i absorptionsspektre over tid.
* renhedsvurdering: Sammenligning af UV -spektret af en prøve med en kendt standard kan hjælpe med at vurdere dens renhed.
4. Begrænsninger af UV -spektroskopi:
* begrænset strukturel information: UV -spektre giver begrænset information om den overordnede struktur af et molekyle. Det bruges bedst i forbindelse med andre spektroskopiske teknikker som NMR og IR.
* interferenser: Tilstedeværelsen af andre absorberende arter i prøven kan forstyrre analysen.
* opløsningsmiddeleffekter: Det anvendte opløsningsmiddel kan påvirke UV -spektret af analytten. At vælge et passende opløsningsmiddel er afgørende.
5. Eksempler på UV -analyse:
* benzen: Det karakteristiske UV-absorptionsbånd omkring 200 nm skyldes π-π* overgange af den aromatiske ring.
* acetone: Absorptionsbåndet ved 270 nm tilskrives N-π* overgangen af carbonylgruppen.
* konjugerede diener: Absorptionsmaksimum skifter til længere bølgelængder, når konjugeringsgraden øges.
6. Fremskridt i UV -spektroskopi:
* diode array -spektrometre: Disse instrumenter kan samtidig registrere hele UV -spektret, hvilket muliggør hurtig analyse.
* UV-Vis spektrofotometre: Kombination af UV og synlig lysanalyse giver en bredere række oplysninger om de elektroniske overgange.
Konklusion:
UV -spektroskopi spiller en betydelig rolle i analysen af organiske forbindelser, hvilket giver værdifuld indsigt i deres struktur, elektroniske overgange og egenskaber. Når de kombineres med andre spektroskopiske teknikker og kombineret med kemisk viden, tilbyder UV -spektre et kraftfuldt værktøj til identifikation, kvantificering og strukturel belystning.
 Varme artikler
Varme artikler
-
 Ny forskning viser begrænsningerne af koordination i kemiBrint i sin plasmatilstand. Kredit:Alchemist-hp En almindelig antagelse i kemi er, at koordinationstallet for en katalysators overflade bestemmer reaktiviteten af den reaktion, den katalyserer.
Ny forskning viser begrænsningerne af koordination i kemiBrint i sin plasmatilstand. Kredit:Alchemist-hp En almindelig antagelse i kemi er, at koordinationstallet for en katalysators overflade bestemmer reaktiviteten af den reaktion, den katalyserer. -
 Masseproduktion af individualiserede produkterRobot-assisteret inkjet print på 3D overflader hos Fraunhofer ENAS. Kredit:Biermann&Jung Hvordan kan masseproduktionsmetoder anvendes på individualiserede produkter? Et svar er at bruge en kombina
Masseproduktion af individualiserede produkterRobot-assisteret inkjet print på 3D overflader hos Fraunhofer ENAS. Kredit:Biermann&Jung Hvordan kan masseproduktionsmetoder anvendes på individualiserede produkter? Et svar er at bruge en kombina -
 Hvordan motion kan hjælpe med at bekæmpe stofmisbrugKredit:American Chemical Society Sirenekaldet fra vanedannende stoffer kan være svært at modstå, og at vende tilbage til det miljø, hvor der tidligere blev taget stoffer, kan gøre modstanden så me
Hvordan motion kan hjælpe med at bekæmpe stofmisbrugKredit:American Chemical Society Sirenekaldet fra vanedannende stoffer kan være svært at modstå, og at vende tilbage til det miljø, hvor der tidligere blev taget stoffer, kan gøre modstanden så me -
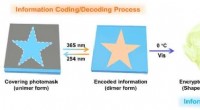 Ny fluorescerende organohydrogel foreslået for at opnå dobbelt informationskrypteringInformationskodning/dekodning og kryptering/dekryptering baseret på den fluorescerende organohydrogel. Kredit:NIMTE Smart Polymer Materials Group ledet af prof. Chen Tao ved Ningbo Institute of Mat
Ny fluorescerende organohydrogel foreslået for at opnå dobbelt informationskrypteringInformationskodning/dekodning og kryptering/dekryptering baseret på den fluorescerende organohydrogel. Kredit:NIMTE Smart Polymer Materials Group ledet af prof. Chen Tao ved Ningbo Institute of Mat
- Forskning styrker indsatsen for at planlægge smartere, mere robuste byer
- Hvordan man fortæller en kvindelig og mandlig Tiger Apart
- Sådan beregnes ændringen i temperatur
- Hvilket fosfat er polært?
- Vi skal se forbi kortsigtede tørkeløsninger og forbedre selve jorden
- Hvordan man løser til hældning i algebra 1


