Holdes gaspartikler tættere end flydende partikler?
Her er hvorfor:
* Intermolekylære kræfter: Kræfterne til tiltrækning mellem partikler (intermolekylære kræfter) er meget svagere i gasser end i væsker. I gasser er disse kræfter næsten ubetydelige, hvilket gør det muligt for partikler at bevæge sig frit og uafhængigt. I væsker er disse kræfter stærkere og holder partiklerne tættere sammen, men giver dem stadig mulighed for at bevæge sig rundt.
* densitet: Gasser er meget mindre tætte end væsker. Dette skyldes, at partiklerne i en gas er spredt meget længere fra hinanden end i en væske. Dette betyder, at de intermolekylære kræfter er svagere, og partiklerne kan bevæge sig mere frit.
Kortfattet: Gaspartikler holdes mindre Tæt end flydende partikler på grund af svagere intermolekylære kræfter og større afstand mellem partikler.
Sidste artikelKemikalier, der letter bevægelsen af impulser ved synapser?
Næste artikelHvad er tekstur på en ametyst?
 Varme artikler
Varme artikler
-
 Rodbakterie til at bekæmpe Alzheimers:Rhizolutin adskiller beta- og tau-aggregaterKredit: Angewandte Chemie International Edition En bakterie fundet i jorden tæt på rødderne af ginsengplanter kunne give en ny tilgang til behandling af Alzheimers. Rhizolutin, en ny klasse af fo
Rodbakterie til at bekæmpe Alzheimers:Rhizolutin adskiller beta- og tau-aggregaterKredit: Angewandte Chemie International Edition En bakterie fundet i jorden tæt på rødderne af ginsengplanter kunne give en ny tilgang til behandling af Alzheimers. Rhizolutin, en ny klasse af fo -
 Forskere udvikler unikt glødende proteinKredit:MIPT Biofysikere fra Moskva Institut for Fysik og Teknologi er gået sammen med kolleger fra Frankrig og Tyskland for at skabe et nyt fluorescerende protein. Udover at gløde, når det bestrål
Forskere udvikler unikt glødende proteinKredit:MIPT Biofysikere fra Moskva Institut for Fysik og Teknologi er gået sammen med kolleger fra Frankrig og Tyskland for at skabe et nyt fluorescerende protein. Udover at gløde, når det bestrål -
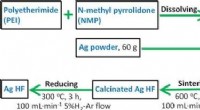 Forskere foreslår en ny metode til at forbedre den elektrokatalytiske omdannelse af kuldioxidDiagram over de detaljerede fremstillingsprocedurer for Ag HF. Kredit:Angewandte Chemie International Edition (2022). DOI:10.1002/anie.202210432 Et forskerhold ledet af Profs. Chen Wei og Wei Wei f
Forskere foreslår en ny metode til at forbedre den elektrokatalytiske omdannelse af kuldioxidDiagram over de detaljerede fremstillingsprocedurer for Ag HF. Kredit:Angewandte Chemie International Edition (2022). DOI:10.1002/anie.202210432 Et forskerhold ledet af Profs. Chen Wei og Wei Wei f -
 Undersøgelse af oxidative veje i atombrændstofDet radiokemiske behandlingslaboratorium på PNNL er hjemsted for et JEOL GrandARM-300F scanningstransmissionselektronmikroskop, her drives af materialeforsker Steven Spurgeon. Denne specialiserede fac
Undersøgelse af oxidative veje i atombrændstofDet radiokemiske behandlingslaboratorium på PNNL er hjemsted for et JEOL GrandARM-300F scanningstransmissionselektronmikroskop, her drives af materialeforsker Steven Spurgeon. Denne specialiserede fac
- Fordele og ulemper ved at bruge Thermocouples
- Ny forskning viser, at mikroevolution kan bruges til at forudsige, hvordan evolution fungerer på me…
- Trumps offshore olieboringsplaner ignorerer erfaringerne fra BP Deepwater Horizon
- Ny metode til at bygge på atomskala
- Præstationsfremmende stofbrug:Et link til kriminelle handlinger
- Hvilke gamle fodspor kan fortælle os om, hvordan det var at være barn i forhistorisk tid


