Hvad sker der med en gas, da den afkøles under 0 grader?
* afkøling af en gas: Når en gas afkøles, bremser dens molekyler. Dette betyder, at de har mindre kinetisk energi og kolliderer sjældnere. Dette fører til:
* Nedsat pres: Færre kollisioner betyder mindre tryk, der udøves på beholderen.
* Nedsat volumen: Hvis beholderen er fleksibel, falder volumenet, når gassen afkøles, og trykket falder.
* Ændringer i tilstand: Til sidst vil gassen afkøle nok til, at molekylerne vil bremse så meget, at de begynder at tiltrække hinanden. Dette er, når gasovergange til en væske.
* 0 grader (Celsius): Dette er bare et punkt på temperaturskalaen, det har ikke nogen særlig betydning for gasser. Mange gasser kan forblive i en gasformig tilstand under 0 grader celsius.
Eksempel: Vanddamp (gasformigt vand) kan eksistere godt under 0 grader celsius. Det er først, når temperaturen når frysepunktet for vand (0 grader celsius), at det begynder at kondensere i flydende vand.
Nøglepunkt: Temperaturen, hvormed en gasovergange til en væske afhænger af den specifikke gas. Denne temperatur kaldes kogepunkt (eller kondensationspunkt).
 Varme artikler
Varme artikler
-
 Farligt vildtgræs vil blive brugt i batterierSupercapacitor Kredit:NUST MISIS Hogweed, som vokser over store områder i Rusland, kan være nyttigt som materiale til batterier. Forskere fra NUST MISIS har undersøgt mulighederne for fibrøse stof
Farligt vildtgræs vil blive brugt i batterierSupercapacitor Kredit:NUST MISIS Hogweed, som vokser over store områder i Rusland, kan være nyttigt som materiale til batterier. Forskere fra NUST MISIS har undersøgt mulighederne for fibrøse stof -
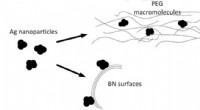 Bornitrid og sølv nanopartikler for at hjælpe med at slippe af med kulilte-emissionerSkemaet med at syntetisere nanohybridkatalysatoren fra lagdelt bornitrid, sølv nanopartikler, og polyethylenglycol. Kredit:Anton S. Konopatsky et al./ Journal of Catalysis , 2018 Russiske kemike
Bornitrid og sølv nanopartikler for at hjælpe med at slippe af med kulilte-emissionerSkemaet med at syntetisere nanohybridkatalysatoren fra lagdelt bornitrid, sølv nanopartikler, og polyethylenglycol. Kredit:Anton S. Konopatsky et al./ Journal of Catalysis , 2018 Russiske kemike -
 Tager gætværket ud af retsmedicinsk analyse af fingermærkerForskere bruger infrarøde lasere til at løfte fingeraftryk fra gerningssteder. Kredit:LSU Forskere ved Louisiana State University Department of Chemistry, herunder postdoc-forsker Fabrizio Donnaru
Tager gætværket ud af retsmedicinsk analyse af fingermærkerForskere bruger infrarøde lasere til at løfte fingeraftryk fra gerningssteder. Kredit:LSU Forskere ved Louisiana State University Department of Chemistry, herunder postdoc-forsker Fabrizio Donnaru -
 ArtSea Ink:en farverig, tangbaseret blæk til 3D-printGlimmerpulver blev spredt i alginatopløsninger for at gøre levende, perlemorsfarvede blæk til 3D-print. Kredit:Tilpasset fra ACS Omega Nogle kunstnere omfavner 3D-print som et nyt medie, giver dem
ArtSea Ink:en farverig, tangbaseret blæk til 3D-printGlimmerpulver blev spredt i alginatopløsninger for at gøre levende, perlemorsfarvede blæk til 3D-print. Kredit:Tilpasset fra ACS Omega Nogle kunstnere omfavner 3D-print som et nyt medie, giver dem
- Hvad er bakterierne, der forårsager åreforkalkning?
- Vælger-ID-love diskriminerer racemæssige og etniske minoriteter, afslører ny undersøgelse
- Nogle cybersikkerhedsapps kunne være værre for privatlivets fred end slet ingenting
- NASA kaster et infrarødt øje på den tropiske storm Irwin
- Hvilket område på det nordamerikanske kontinent har den største risiko for risiko for risiko?
- Hvordan våben giver anledning til masseskyderier i Amerika


