Hvad hedder de forskellige sektioner af periodisk tabel?
1. Perioder:
- Horisontale rækker kaldes perioder .
- Der er 7 perioder I den periodiske tabel nummereret 1 til 7.
- Elementer inden for en periode har det samme antal elektronskaller.
2. Grupper (eller familier):
- Lodrette kolonner kaldes grupper eller familier .
- Der er 18 grupper I den periodiske tabel nummereret 1 til 18.
- Elementer inden for en gruppe har det samme antal valenselektroner (elektroner i den yderste skal) og deler lignende kemiske egenskaber.
3. Blokke:
- Den periodiske tabel er også opdelt i fire blokke Baseret på de underskaller, der udfyldes:
- s-blok: Grupper 1 og 2 (alkali og alkaliske jordmetaller)
- p-blok: Grupper 13 til 18 (inklusive ikke -metaller, halogener og ædelgasser)
- d-blok: Grupper 3 til 12 (overgangsmetaller)
- f-blok: Lanthanider og actinider (indre overgangsmetaller)
4. Andre klassifikationer:
- metaller: De fleste elementer er metaller. De er generelt skinnende, formbare, duktile og gode ledere af varme og elektricitet.
- ikke -metaller: Placeret på højre side af det periodiske tabel mangler ikke -metaller egenskaber ved metaller.
- metalloider: Disse elementer har egenskaber, der ligger mellem metaller og ikke -metaller. De er også kendt som semimetaler.
- Repræsentative elementer: Disse elementer er placeret i S-blokken og P-blokken.
- Overgangselementer: Disse elementer er placeret i D-blokken og har variable oxidationstilstande.
At forstå disse forskellige sektioner hjælper dig med at forstå tendenser i egenskaber på tværs af den periodiske tabel.
Sidste artikelI hvilken kolonne er beryllium i?
Næste artikelHvad sker der med en gas, da den afkøles under 0 grader?
 Varme artikler
Varme artikler
-
 Hook-on medicin:Ny leveringsstrategi for K-Ras disruptionDr. Ohkanda holder sammensætningen strategisk designet til at hægte sig ind i hullet i enzymet. Kredit:Junko Ohkanda Ph.D., Professor i Akademisk Forsamling, Landbrugsinstituttet, Shinshu Universitet
Hook-on medicin:Ny leveringsstrategi for K-Ras disruptionDr. Ohkanda holder sammensætningen strategisk designet til at hægte sig ind i hullet i enzymet. Kredit:Junko Ohkanda Ph.D., Professor i Akademisk Forsamling, Landbrugsinstituttet, Shinshu Universitet -
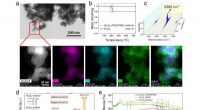 Direkte oxidativ overførselsproces bidrager til vandrensningProduktanalyser af modelreaktionssystemet (Co3 O4 /PMS/PhOH). et STEM, HAADF og EDS elementær kortlægningsbilleder af Co3 O4 efter reaktionen. b TGA-kurver for den uberørte og reagerede Co3 O4 i lufte
Direkte oxidativ overførselsproces bidrager til vandrensningProduktanalyser af modelreaktionssystemet (Co3 O4 /PMS/PhOH). et STEM, HAADF og EDS elementær kortlægningsbilleder af Co3 O4 efter reaktionen. b TGA-kurver for den uberørte og reagerede Co3 O4 i lufte -
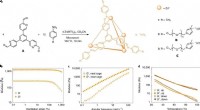 Porøs væske rummer større molekylerForberedelse og reologi af bure 1-3. Kredit: Naturkemi (2020). DOI:10.1038/s41557-020-0419-2 Et internationalt team af kemikere har udviklet en metode til at skabe en ionisk væske, porøs, tetraed
Porøs væske rummer større molekylerForberedelse og reologi af bure 1-3. Kredit: Naturkemi (2020). DOI:10.1038/s41557-020-0419-2 Et internationalt team af kemikere har udviklet en metode til at skabe en ionisk væske, porøs, tetraed -
 Opfinder verdens stærkeste sølvInde i et sølvkorn, kobberatomurenheder (i grønt) er blevet selektivt adskilt til en korngrænse (til venstre) og til indre defekter (lange strenge, streamer nedad.) Dette øjebliksbillede, fra en atomi
Opfinder verdens stærkeste sølvInde i et sølvkorn, kobberatomurenheder (i grønt) er blevet selektivt adskilt til en korngrænse (til venstre) og til indre defekter (lange strenge, streamer nedad.) Dette øjebliksbillede, fra en atomi


