Hvad er kraften, der binder vandmolekyler sammen?
Her er en sammenbrud:
* Polaritet: Vandmolekyler er polære, hvilket betyder, at de har en lidt positiv ende (nær brintatomerne) og en lidt negativ ende (nær iltatomet). Dette forekommer, fordi ilt er mere elektronegativt end brint, og trækker de delte elektroner tættere på sig selv.
* attraktion: Den positive ende af et vandmolekyle tiltrækkes af den negative ende af et andet vandmolekyle. Denne attraktion kaldes en brintbinding.
* styrke: Hydrogenbindinger er relativt svage sammenlignet med kovalente bindinger, men de er stadig vigtige, fordi de holder vandmolekyler sammen, hvilket giver vand sine unikke egenskaber.
egenskaber ved vand, der skyldes hydrogenbinding:
* Højt kogepunkt: Vand har et højere kogepunkt end forventet for sin molekylvægt på grund af den energi, der kræves for at bryde brintbindingerne.
* Høj overfladespænding: Vandmolekyler på overfladen tiltrækkes stærkere af hinanden end til luften, hvilket skaber en stærk overfladespænding.
* universelt opløsningsmiddel: Water's polaritet giver det mulighed for at opløse mange stoffer, hvilket gør det til et godt opløsningsmiddel.
Sammenfattende er hydrogenbinding den kraft, der holder vandmolekyler sammen og giver vand sine unikke egenskaber.
 Varme artikler
Varme artikler
-
 Forskere opdager skjult SARS-CoV-2-port, der åbner for at tillade COVID-infektionSiden de tidlige dage af COVID-pandemien, forskere har aggressivt forfulgt hemmelighederne bag de mekanismer, der gør det muligt for alvorligt akut respiratorisk syndrom coronavirus 2 (SARS-CoV-2) at
Forskere opdager skjult SARS-CoV-2-port, der åbner for at tillade COVID-infektionSiden de tidlige dage af COVID-pandemien, forskere har aggressivt forfulgt hemmelighederne bag de mekanismer, der gør det muligt for alvorligt akut respiratorisk syndrom coronavirus 2 (SARS-CoV-2) at -
 Undersøgelse af bedre biotransformationerMadagaskar periwinkle. Kredit:Wikimedia Commons, CC BY-SA Forskning i International Journal of Bioinformatics Research and Applications har undersøgt kemien og opførselen af et nyttigt naturprodu
Undersøgelse af bedre biotransformationerMadagaskar periwinkle. Kredit:Wikimedia Commons, CC BY-SA Forskning i International Journal of Bioinformatics Research and Applications har undersøgt kemien og opførselen af et nyttigt naturprodu -
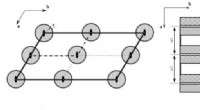 En ny klassificering af symmetrigrupper i krystalrummet foreslået af russiske videnskabsmændForbudt volumen i todimensionelle rumsymmetrigrupper:(venstre) p2 og (højre) pm. Bølget fyldning angiver forbudte områder. Kredit:Lobachevsky University Det indbyrdes arrangement af atomer i kryst
En ny klassificering af symmetrigrupper i krystalrummet foreslået af russiske videnskabsmændForbudt volumen i todimensionelle rumsymmetrigrupper:(venstre) p2 og (højre) pm. Bølget fyldning angiver forbudte områder. Kredit:Lobachevsky University Det indbyrdes arrangement af atomer i kryst -
 UNT professorers virtuelle laboratorium kan være nøglen til at forhindre lækager af undersøiske …University of North Texas assisterende professor Oliviero Andreussi. Kredit:UNT Komplekse organisk kemi eksperimenter tager ofte dage eller uger at udføre i et laboratorium, men ikke længere. Oliv
UNT professorers virtuelle laboratorium kan være nøglen til at forhindre lækager af undersøiske …University of North Texas assisterende professor Oliviero Andreussi. Kredit:UNT Komplekse organisk kemi eksperimenter tager ofte dage eller uger at udføre i et laboratorium, men ikke længere. Oliv
- Den store jury sigter fire Audi-chefer i emissionssagen
- Sjove spil og aktiviteter for Field Day
- Hvad er studiet af jordens fysiske struktur og historie?
- Har en celles køn betydning i forskning?
- Hvordan maskinlæring hjalp med at udvikle en ny algoritme, der kunne tilføre liv til broer
- Sydkorea tester levering af droner i fjerntliggende regioner


