Hvorfor kan du ikke tilføje de gennemsnitlige masser af hver isotop og dele for at få generelle atomer?
* isotoper har forskellige overflod: Den gennemsnitlige atommasse tegner sig for det faktum, at der findes isotoper i forskellige proportioner i naturen. For eksempel har chlor to større isotoper:klor-35 og chlor-37. Chlor-35 er meget mere rigelig end klor-37. Det ville give dig et nummer, der ikke afspejler den sande distribution.
* Vægtet gennemsnit: Den gennemsnitlige atommasse er faktisk et *vægtet gennemsnit *. Det beregnes ved at overveje massen af hver isotop * og * dens relative overflod. Jo mere rigelig en isotop er, jo mere bidrager dens masse til det samlede gennemsnit.
Sådan fungerer det:
1. Identificer isotoperne: Bestem isotoperne af elementet og deres respektive masser.
2. Find den relative overflod: Bestem procentdelen af hver isotop, der er til stede i naturen (normalt angivet i en periodisk tabel eller en lærebog).
3. Beregn det vægtede gennemsnit: Multiplicer massen af hver isotop med dens overflod (udtrykt som en decimal). Tilføj derefter resultaterne.
Eksempel:klor
* Chlor-35:Masse =34.9689 AMU, overflod =75,77%
* Chlor-37:Masse =36.9659 AMU, overflod =24,23%
Gennemsnitlig atommasse af klor:
(34.9689 amu * 0.7577) + (36.9659 AMU * 0.2423) = 35.453 Amu
Key Takeaway: Du er nødt til at faktor i forekomsten af hver isotop for at beregne den gennemsnitlige atommasse, ikke kun gennemsnittet af deres individuelle masser.
Sidste artikelHvad er massen i gram på 0,0287 mol Socrose?
Næste artikelGiver eller modtager en ion?
 Varme artikler
Varme artikler
-
 Se mor, ingen hænder:Forskere bruger vakuum til håndfri mønstre af flydende metalNorth Carolina State University ingeniører har brugt vakuum til at skabe en mere effektiv, håndfri metode til at fylde komplekse mikrokanaler med flydende metal. Deres arbejde adresserer to af de mest
Se mor, ingen hænder:Forskere bruger vakuum til håndfri mønstre af flydende metalNorth Carolina State University ingeniører har brugt vakuum til at skabe en mere effektiv, håndfri metode til at fylde komplekse mikrokanaler med flydende metal. Deres arbejde adresserer to af de mest -
 Små polymerfjedre giver et boost til miljøoprydningForskere fra Princeton slog et årtier gammelt puslespil inden for væskedynamik, viser, hvorfor specialiserede polymervæsker skyller forurenende stoffer fra grundvandsmagasiner under nogle forhold, men
Små polymerfjedre giver et boost til miljøoprydningForskere fra Princeton slog et årtier gammelt puslespil inden for væskedynamik, viser, hvorfor specialiserede polymervæsker skyller forurenende stoffer fra grundvandsmagasiner under nogle forhold, men -
 Forskere udvikler en ny tilgang til at forudsige, hvordan væsker fryserKredit:Pixabay/CC0 Public Domain Forskere fra Queen Mary University of London har udviklet en ny beregningsmetode til bedre at forstå frysning i forskellige typer væsker. Processen med at fryse,
Forskere udvikler en ny tilgang til at forudsige, hvordan væsker fryserKredit:Pixabay/CC0 Public Domain Forskere fra Queen Mary University of London har udviklet en ny beregningsmetode til bedre at forstå frysning i forskellige typer væsker. Processen med at fryse, -
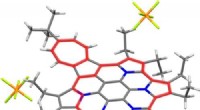 Dobbelt aromatiske ringe stabiliserer multikationerPyrrol- og azulenfusioneret azacoronen-dikering med 22π 6π aromatiske ringe. Kredit:American Chemical Society Et redoxaktivt polycyklisk aromatisk kulbrinte (PAHer) sammensat af azulen og pyrroler
Dobbelt aromatiske ringe stabiliserer multikationerPyrrol- og azulenfusioneret azacoronen-dikering med 22π 6π aromatiske ringe. Kredit:American Chemical Society Et redoxaktivt polycyklisk aromatisk kulbrinte (PAHer) sammensat af azulen og pyrroler
- Hvordan hjælper rumsonder og udforskning?
- Sådan konverteres fra BTU til Fahrenheit
- Boeing-ulykker sætter fokus på den amerikanske luftfartsmyndighed
- Forskere foreslår nyt design til at implementere meget retningsbestemt enkeltfotonkilde
- Landbrug og gødning:hvordan økologiske praksisser kan gøre en forskel
- Er karakteren af akademisk forskning under forandring?


