Hvordan påvirker koncentration hastigheden for en kemisk reaktion?
Kollisionsteorien
Grundlaget for at forstå dette forhold ligger i kollisionsteorien . Denne teori hedder, at for at en reaktion kan forekomme, skal reaktantmolekyler:
1. Kollide: Molekylerne skal fysisk støde på hinanden.
2. kolliderer med tilstrækkelig energi: Kollisionen skal have nok energi til at bryde eksisterende obligationer og danne nye.
3. kolliderer med den korrekte orientering: Molekylerne skal orienteres på en måde, der gør det muligt for de reaktive dele at interagere.
Koncentration og kollisionsfrekvens
* Højere koncentration betyder flere molekyler i et givet rum: Når du øger koncentrationen af reaktanter, mængder du i det væsentlige reaktionsbeholderen. Dette fører til hyppigere kollisioner mellem reaktantmolekyler.
* Flere kollisioner fører til mere succesrige reaktioner: Da hastigheden af en reaktion afhænger af hyppigheden af vellykkede kollisioner, øger en højere koncentration reaktionshastigheden.
Eksempel:
Forestil dig et overfyldt dansegulv. Jo flere mennesker der (højere koncentration), desto mere sandsynligt er det, at to mennesker vil støde på hinanden (kollisioner). Nogle af disse kollisioner kan føre til dans (vellykkede reaktioner).
satsens lov
Det kvantitative forhold mellem koncentration og reaktionshastighed udtrykkes af rate -loven . Det er generelt skrevet som:
hastighed =k [a]^m [b]^n
Hvor:
* sats: Reaktionens hastighed.
* k: Hastighedskonstanten, specifik for reaktionen ved en given temperatur.
* [a], [b]: Koncentrationerne af reaktanter A og B.
* m, n: Reaktionsordrer, hvilket indikerer følsomheden af hastigheden for ændringer i koncentration af hver reaktant.
Vigtige punkter:
* Ikke alle reaktioner påvirkes lige så af koncentrationen: Reaktionens rækkefølge bestemmer, hvor meget hastigheden ændres med koncentrationen. For eksempel vil en reaktion, der er første orden med hensyn til en bestemt reaktant, fordoble sin hastighed, når koncentrationen af denne reaktant fordobles.
* koncentration er kun en faktor: Temperatur, overfladeareal og tilstedeværelsen af katalysatorer påvirker også signifikant reaktionshastigheder.
Sammendrag:
Højere koncentration fører generelt til en hurtigere reaktionshastighed, fordi den øger hyppigheden af vellykkede kollisioner mellem reaktantmolekyler. Det nøjagtige forhold styres af hastighedsloven for den specifikke reaktion.
Sidste artikelHvilket er det bedste sted at finde pH -værdier af salte?
Næste artikelEr oktan og trimethyl pentan organisk?
 Varme artikler
Varme artikler
-
 Madras brændbarhedsstandard er en livredder, NIST-rapport finderTestopsætningen beskrevet i 16 CFR Part 1633 indebærer påføring af gasbrænderhoveder på siden og toppen af en madras i op til 30 minutter. Kredit:B. Hayes/NIST Uanset hvor blødt og hyggeligt, se
Madras brændbarhedsstandard er en livredder, NIST-rapport finderTestopsætningen beskrevet i 16 CFR Part 1633 indebærer påføring af gasbrænderhoveder på siden og toppen af en madras i op til 30 minutter. Kredit:B. Hayes/NIST Uanset hvor blødt og hyggeligt, se -
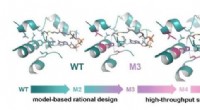 Udvidelse af grænserne for kuldioxidfikseringEngineering af glycolyl-CoA carboxylase (GCC), nøgleenzymet i TaCo-vejen. GCC blev udviklet på stilladset af en naturligt forekommende propionyl-CoA carboxylase (WT). Rationelt design førte til den 50
Udvidelse af grænserne for kuldioxidfikseringEngineering af glycolyl-CoA carboxylase (GCC), nøgleenzymet i TaCo-vejen. GCC blev udviklet på stilladset af en naturligt forekommende propionyl-CoA carboxylase (WT). Rationelt design førte til den 50 -
 Biobaseret forbindelse tilbyder et grønnere kulfiberalternativDen her viste katalytiske reaktor er til omdannelse af kemiske mellemprodukter til acrylonitril. Arbejdet er en del af Renewable Carbon fiber Consortium. Kredit:Dennis Schroeder/NREL Fra biler og
Biobaseret forbindelse tilbyder et grønnere kulfiberalternativDen her viste katalytiske reaktor er til omdannelse af kemiske mellemprodukter til acrylonitril. Arbejdet er en del af Renewable Carbon fiber Consortium. Kredit:Dennis Schroeder/NREL Fra biler og -
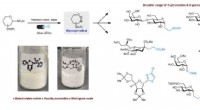 Aktivering af synligt lys muliggør transformation af bordstabile sulfoner til værdifulde glykoside…Skematisk, der viser designet af et synligt lys-medieret system til at krydskoble forskellige elektrofiler med glycosylradikaler afledt af bench-stabile heteroarylsulfoner. Kredit:Nature Synthesis (20
Aktivering af synligt lys muliggør transformation af bordstabile sulfoner til værdifulde glykoside…Skematisk, der viser designet af et synligt lys-medieret system til at krydskoble forskellige elektrofiler med glycosylradikaler afledt af bench-stabile heteroarylsulfoner. Kredit:Nature Synthesis (20
- Hvordan reagerer partikler, når de skifter fra et fast stof til væske og gas?
- 25 arter afsløret for 25 Genomes Project
- Forudsiger hvordan nanopartikler vil reagere i menneskekroppen
- Anmeldelse:Hvorfor abonnere på Office, når så meget er gratis?
- Laserdrevet rover til at udforske månernes mørke skygger
- Hvilken subtomisk partikel har seks forskellige typer?


