Navngiv en fotolytisk reaktion, der ikke er nedbrydningsreaktion?
Her er hvorfor:
* fotolyse involverer brud på kemiske bindinger ved hjælp af lysenergi.
* nedbrydning af reaktioner Opdel en enkelt reaktant i to eller flere produkter.
* klorering af metan involverer reaktionen af methan (CH4) med chlorgas (CL2) i nærvær af UV -lys. Denne proces producerer chlormethan (CH3CL) og hydrogenchlorid (HCI).
reaktion:
CH4 + CL2 → CH3CL + HCL
Forklaring:
1. initiering: UV -lys bryder klormolekylet (CL2) i to klorradikaler (CL •).
2. Formering: En klorradikal reagerer med methan (CH4) for at danne en methylradikal (CH3 •) og HCI.
3. Formering: Methylradikalen reagerer med et andet klormolekyle til dannelse af chlormethan (CH3CL) og en anden klorradikal.
Denne proces fortsætter, indtil al metan eller klor forbruges. Denne reaktion er ikke en nedbrydningsreaktion, fordi den involverer to reaktanter (metan og klor), der danner to produkter (chlormethan og hydrogenchlorid).
Derfor er klorering af methan en fotolytisk reaktion, der ikke er en nedbrydningsreaktion.
 Varme artikler
Varme artikler
-
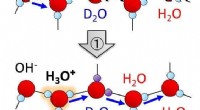 Unikke strukturelle udsving ved isoverfladen fremmer autoionisering af vandmolekylerSkematisk illustration af H/D isotopudvekslingsproces af vandmolekyler induceret af autoionisering og efterfølgende protonoverførsel. Kredit:NINS/IMS Vandis er et af de mest forekommende faste sto
Unikke strukturelle udsving ved isoverfladen fremmer autoionisering af vandmolekylerSkematisk illustration af H/D isotopudvekslingsproces af vandmolekyler induceret af autoionisering og efterfølgende protonoverførsel. Kredit:NINS/IMS Vandis er et af de mest forekommende faste sto -
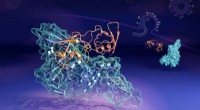 Neutroner fanger formskiftende coronavirus-proteinkompleks på aktenKredit:Oak Ridge National Laboratory Mens alle vira har nogle midler til at bekæmpe kroppens immunsystem, forskere har undersøgt, hvordan SARS-CoV-2-coronavirus - årsagen til den globale COVID-19-
Neutroner fanger formskiftende coronavirus-proteinkompleks på aktenKredit:Oak Ridge National Laboratory Mens alle vira har nogle midler til at bekæmpe kroppens immunsystem, forskere har undersøgt, hvordan SARS-CoV-2-coronavirus - årsagen til den globale COVID-19- -
 Kemikere syntetiserer ultrahurtig cyaniddetektorKredit:CC0 Public Domain Organiske kemikere ved Kaunas University of Technology (KTU), Litauen har syntetiseret et nyt materiale, som kan bruges som en detektor for cyanider i vand. Ved kontakt me
Kemikere syntetiserer ultrahurtig cyaniddetektorKredit:CC0 Public Domain Organiske kemikere ved Kaunas University of Technology (KTU), Litauen har syntetiseret et nyt materiale, som kan bruges som en detektor for cyanider i vand. Ved kontakt me -
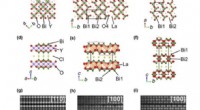 Teambilledressourcer brugt i internationalt eksperiment med nye fotokatalysatorerKredit:Skolkovo Institut for Videnskab og Teknologi Skoltech-forskere hjalp deres kolleger fra Japan, Tyskland, De Forenede Stater, og Kina studerer krystalstrukturen og optiske egenskaber af en n
Teambilledressourcer brugt i internationalt eksperiment med nye fotokatalysatorerKredit:Skolkovo Institut for Videnskab og Teknologi Skoltech-forskere hjalp deres kolleger fra Japan, Tyskland, De Forenede Stater, og Kina studerer krystalstrukturen og optiske egenskaber af en n
- SpaceX er klar til at sprænge NASAs nye planetjæger afsted, TESS
- For mange skildpadder? Forskere kan have løst mysteriet om Raine Island
- Sådan beregnes Radius
- Forskere afslører det kolde hjerte af landfaldende orkaner
- Hvad sker der, når du blander kaliumpermanganat med olie?
- Indledende fund af kunstig påvirkning af asteroiden Ryugu


