Hvad er de generelle egenskaber ved elementer i de første to grupper på periodisk tabel på højre side?
Her er en sammenbrud af deres generelle egenskaber:
halogener (gruppe 17):
* Meget reaktiv: De får let en elektron til at danne en stabil negativ ion (halogenidion).
* ikke -metaller: De findes som diatomiske molekyler (F₂, Cl₂, Br₂, I₂, ved₂) ved stuetemperatur.
* Varierende tilstande af stof: Fluor og klor er gasser, brom er en væske, og jod og astatin er faste stoffer.
* formularfarvede forbindelser: Halogenforbindelser er ofte farverige.
* Vigtigt i biologiske systemer: Halogener er vigtige for livet, især jod (skjoldbruskkirtelhormon) og klor (salt).
* Brugt i forskellige applikationer: Halogener bruges i desinfektionsmidler, farmaceutiske produkter og industrielle processer.
ædle gasser (gruppe 18):
* inerte gasser: De er ekstremt ureaktive på grund af deres fulde ydre elektronskaller.
* farveløs og lugtfri: De er gasser ved stuetemperatur.
* lave kogepunkter: De er meget svagt tiltrukket af hinanden.
* forekommer naturligt i atmosfæren: Argon er den mest rigelige ædle gas i atmosfæren.
* Brugt i forskellige applikationer: Helium bruges i balloner og i magnetisk resonansafbildning (MRI), neon bruges i neonskilte, argon bruges i svejsning og som en inert atmosfære, og Krypton og Xenon bruges i belysning.
Nøgleforskelle:
* reaktivitet: Halogener er meget reaktive, mens ædle gasser næsten er inerte.
* Elektronkonfiguration: Halogener har en mindre elektron end en fuld ydre skal, mens ædelgasser har en fuld ydre skal.
* Dannelse af ioner: Halogener danner negative ioner, mens ædle gasser ikke let danner ioner.
Husk, at dette bare er generelle tendenser. Der er undtagelser og variationer inden for hver gruppe, og elementernes egenskaber bliver mere komplekse, når du bevæger dig ned ad den periodiske tabel.
Sidste artikelHvorfor er der H3O?
Næste artikelHvad ønsker kernen i et atom at udføre elektroner i nærheden af Atom?
 Varme artikler
Varme artikler
-
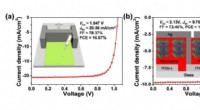 Organiske småmolekyle hultransporterende lag mod effektive p-i-n perovskit solcellerPero-SCer baseret på bladbelagt BDT-TPA-sTh HTL- og MAPbI3-aktivt lag:(a) J-V-kurver i omvendt scanningsretning; indsats:skematisk illustration af bladbelagte HTLer. (b) J-V-kurver for et 1 cm2 pero-S
Organiske småmolekyle hultransporterende lag mod effektive p-i-n perovskit solcellerPero-SCer baseret på bladbelagt BDT-TPA-sTh HTL- og MAPbI3-aktivt lag:(a) J-V-kurver i omvendt scanningsretning; indsats:skematisk illustration af bladbelagte HTLer. (b) J-V-kurver for et 1 cm2 pero-S -
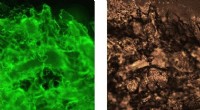 Forskere udvikler gel lavet af edderkoppesilkeproteiner til biomedicinske anvendelserHydrogelerne farves med et fluorescerende farvestof, der binder til amyloidstrukturer og det tilsvarende lysfeltbillede. Kredit:Tina Arndt Forskere ved KI og SLU har opdaget, at edderkoppesilkeprot
Forskere udvikler gel lavet af edderkoppesilkeproteiner til biomedicinske anvendelserHydrogelerne farves med et fluorescerende farvestof, der binder til amyloidstrukturer og det tilsvarende lysfeltbillede. Kredit:Tina Arndt Forskere ved KI og SLU har opdaget, at edderkoppesilkeprot -
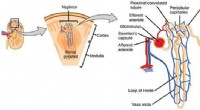 Enhed til at fremskynde opdagelse af lægemidler til nyresygdommeKredit:CNX OpenStax Forskere fra Institut for Ingeniørvidenskab samarbejder med industrien og den akademiske verden om at udvikle et apparat til at forbedre testningen af lægemidler til nyresygd
Enhed til at fremskynde opdagelse af lægemidler til nyresygdommeKredit:CNX OpenStax Forskere fra Institut for Ingeniørvidenskab samarbejder med industrien og den akademiske verden om at udvikle et apparat til at forbedre testningen af lægemidler til nyresygd -
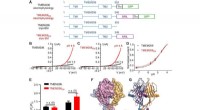 Kryo-elektronmikroskopisk struktur af en protonaktiveret kloridkanal ved navn TMEM206Funktion og struktur af pufferfish TMEM206. (A) Skematisk af kanalkonstruktioner, der anvendes til elektrofysiologi og enkeltpartikel-kryo-EM-eksperimenter. Thr repræsenterer et thrombin-spaltningsste
Kryo-elektronmikroskopisk struktur af en protonaktiveret kloridkanal ved navn TMEM206Funktion og struktur af pufferfish TMEM206. (A) Skematisk af kanalkonstruktioner, der anvendes til elektrofysiologi og enkeltpartikel-kryo-EM-eksperimenter. Thr repræsenterer et thrombin-spaltningsste
- Hvad kaldes vand, der suger ned i jorden?
- Kystoversvømmelser i bugten udløser landsdækkende pendlingsforstyrrelser
- Hvad er en form for energi, der resulterer i, at tiltrækningsobjekter bliver lavet til jern?
- Udfylde et vigtigt hul i klimamodeller
- Hvorfor har vi brug for en blå kulstofinvesterings-køreplan
- Forskere sporer dyb historie om planeters bevægelser, og indvirkning på jordens klima


