Hvilket volumen af en gas øger sit tryk falder?
Boyle's Law siger:
* ved en konstant temperatur , volumenet af en given masse af en ideel gas er omvendt proportional med dens tryk.
i enklere termer:
* Hvis du øger volumenet af en gas, vil dens tryk falde.
* Hvis du reducerer volumenet af en gas, vil dens tryk stige.
Tænk på det sådan:
Forestil dig, at du har en ballon fyldt med luft. Hvis du klemmer ballonen, reducerer du dens volumen. Den samme mængde luft presses nu ind i et mindre rum, hvilket får presset inde i ballonen til at stige. Omvendt, hvis du slipper ballonen, udvides den, øger volumenet og reducerer trykket.
Vigtig note: Dette forhold gælder for ideelle gasser og antager konstant temperatur. I virkeligheden er gasser ikke helt ideelle, og der kan være lette afvigelser fra denne lov.
Sidste artikelKan du opløse 0,35 mol kaliumpermanganat (KMNO4) i 500 ml vand?
Næste artikelHvilket smeltepunkt har lim?
 Varme artikler
Varme artikler
-
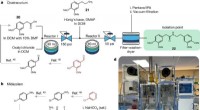 Et computersystem, der analyserer kemisk affald og foreslår måder at fremstille nye produkter af d…Synteser af COVID-19 intensivafdelingsmedicin eller deres mellemprodukter udført på en automatiseret, modulær ODP-platform. a–c, Allchemy-designede, waste-to-drug synteser af nøglemellemprodukter af c
Et computersystem, der analyserer kemisk affald og foreslår måder at fremstille nye produkter af d…Synteser af COVID-19 intensivafdelingsmedicin eller deres mellemprodukter udført på en automatiseret, modulær ODP-platform. a–c, Allchemy-designede, waste-to-drug synteser af nøglemellemprodukter af c -
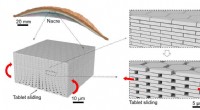 Ny type glas inspireret af naturen er mere modstandsdygtig over for stødMikroarkitekturen af Nacre og tablet, der glider i Nacre. Kredit:Z. Yin, F. Hannard, F. Barthelat Ved at bruge den iriserende perlemor, der ofte findes foring af muslingeskaller, forskere har ko
Ny type glas inspireret af naturen er mere modstandsdygtig over for stødMikroarkitekturen af Nacre og tablet, der glider i Nacre. Kredit:Z. Yin, F. Hannard, F. Barthelat Ved at bruge den iriserende perlemor, der ofte findes foring af muslingeskaller, forskere har ko -
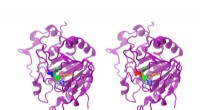 Simulering af AsqJ-enzymet åbner op for nye muligheder for farmaceutisk kemiMens forskellen mellem den naturlige og den modificerede AsqJ kun er én aminosyre, reaktiviteten er klart anderledes. Den naturlige AsqJ (venstre) har en valin i position 72 (blå). Den modificerede fo
Simulering af AsqJ-enzymet åbner op for nye muligheder for farmaceutisk kemiMens forskellen mellem den naturlige og den modificerede AsqJ kun er én aminosyre, reaktiviteten er klart anderledes. Den naturlige AsqJ (venstre) har en valin i position 72 (blå). Den modificerede fo -
 Verdens første ultralydsbiosensor skabt i AustralienKredit:CC0 Public Domain Evnen til nøjagtigt at overvåge lægemiddelniveauer og biologiske molekyler inde i patienter i realtid har stort set været uhåndgribelig. De fleste af de implanterbare mon
Verdens første ultralydsbiosensor skabt i AustralienKredit:CC0 Public Domain Evnen til nøjagtigt at overvåge lægemiddelniveauer og biologiske molekyler inde i patienter i realtid har stort set været uhåndgribelig. De fleste af de implanterbare mon
- Genbrug af bordservice kan reducere spild fra online madleverancer
- Fokuser på det positive for at forbedre klasseværelsets adfærd
- Forskere finder, at grønlandske gletsjersmeltevand er rigt på kviksølv
- Hvorfor vokser planter til klipper?
- Undersøgelse viser hidtil usete ændringer i verdens floder
- Er det sandt, at når iskubler smelter absorberer energi?


