Når fast stof opløses i en væske?
1. Interaktion mellem opløst stof og opløsningsmiddel:
* opløst: Det faste stof, der opløses.
* opløsningsmiddel: Væsken, der opløses opløsningen.
Solute- og opløsningsmiddelmolekylerne interagerer med hinanden. Opløsningsmiddelmolekylerne omgiver de opløste molekyler, bryder dem fra hinanden og trækker dem ind i opløsningen.
2. Dannelse af en løsning:
* Løsning: En homogen blanding af opløst stof og opløsningsmiddel.
* homogen: Opløsningen er jævnt fordelt over opløsningsmidlet.
Solute -partiklerne er nu spredt i hele opløsningsmidlet og danner en opløsning.
3. Faktorer, der påvirker opløselighed:
* Temperatur: Opløselighed øges normalt med temperaturen, da der er mere energi til rådighed for at bryde de opløste molekyler fra hinanden.
* tryk: Tryk har en ubetydelig effekt på opløseligheden af faste stoffer i væsker.
* Natur af opløst stof og opløsningsmiddel: "Som opløser som". Polære opløste stoffer opløses i polære opløsningsmidler (f.eks. Sukker i vand), og ikke -polære opløste stoffer opløses i ikke -polære opløsningsmidler (f.eks. Olie i benzin).
Kortfattet:
Opløsning er en proces, hvor en solid nedbrydes i individuelle partikler, som derefter omgives og spredes af opløsningsmiddelmolekylerne, hvilket danner en homogen blanding kaldet en opløsning. Denne proces er påvirket af faktorer som temperatur og arten af det opløste stof og opløsningsmiddel.
 Varme artikler
Varme artikler
-
 Opdagelse af afgiftningsenzym kunne bruges til at målrette mod større afgrødeforurenende stofferKredit:CC0 Public Domain Planter har udviklet afgiftningsforsvarssystemer som beskyttelse mod en række miljømæssige eller patogenproducerede forurenende stoffer. Sammenlignet med enzymer af primæ
Opdagelse af afgiftningsenzym kunne bruges til at målrette mod større afgrødeforurenende stofferKredit:CC0 Public Domain Planter har udviklet afgiftningsforsvarssystemer som beskyttelse mod en række miljømæssige eller patogenproducerede forurenende stoffer. Sammenlignet med enzymer af primæ -
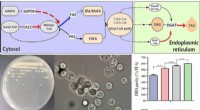 Cellefabrik, der kan producere højrent DHAEn DHA-cellefabrik med høj renhed skabt ved hjælp af metaboliske manipulationsmetoder. Kredit:WANG Sen og SONG Xiaojin Docosahexaensyre (DHA, C22:6) er et vigtigt næringsstof for hjernen og den vi
Cellefabrik, der kan producere højrent DHAEn DHA-cellefabrik med høj renhed skabt ved hjælp af metaboliske manipulationsmetoder. Kredit:WANG Sen og SONG Xiaojin Docosahexaensyre (DHA, C22:6) er et vigtigt næringsstof for hjernen og den vi -
 Et nærmere kig på tynd isKredit:University of Pennsylvania På kølige dage, vanddamp i luften kan omdannes direkte til fast is, aflejring af et tyndt lag på overflader såsom en rude eller bilrude. Selvom det er almindeligt
Et nærmere kig på tynd isKredit:University of Pennsylvania På kølige dage, vanddamp i luften kan omdannes direkte til fast is, aflejring af et tyndt lag på overflader såsom en rude eller bilrude. Selvom det er almindeligt -
 Plasmaprotein kan holde løfte om sårstilladserKredit:CC0 Public Domain Forskere i Tyskland har ansat et plasmaprotein, der findes i blod, til at udvikle en ny metode til fremstilling af sårhelende vævsstilladser. Teamets nye stillads kan fas
Plasmaprotein kan holde løfte om sårstilladserKredit:CC0 Public Domain Forskere i Tyskland har ansat et plasmaprotein, der findes i blod, til at udvikle en ny metode til fremstilling af sårhelende vævsstilladser. Teamets nye stillads kan fas
- Hvordan bakterier klæber til celler:Grundlag for udviklingen af en ny klasse af antibiotika
- Video:Hvordan sølv nanopartikler skærer lugt
- Hvilke metaller ekstraheres ved hjælp af fytominering?
- Udeladt til tørring:En mere effektiv måde at høste algebiomasse på
- Hvad er en reaktionsvariabel i videnskabsprojekter?
- Massespektrometriteknik hjælper med at identificere forfalskede Robert Burns-manuskripter


