Hvordan bakterier klæber til celler:Grundlag for udviklingen af en ny klasse af antibiotika
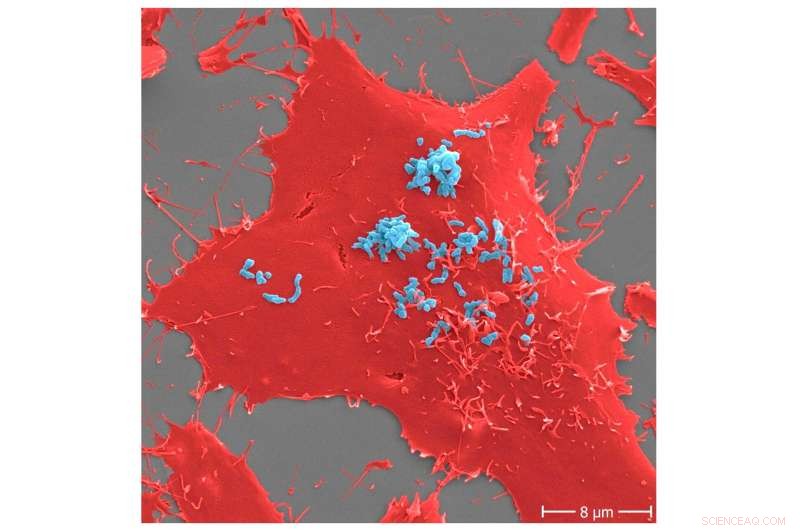
Adhæsion af Bartonella henselae til humane celler. B. henselae (stamme Marseille) bakterier (lyseblå) i en tidlig infektionsproces (30 min) til humane HeLa-229-celler (røde). Adhæsion til værtsceller medieres af specifikke interaktioner mellem B. henselae overfladeproteiner og komponenter af værtens ekstracellulære matrix, herunder molekyler såsom fibronectin eller kollagen. Målestok:8 μm. Kredit:Microbiology Spectrum (2022). DOI:10.1128/spectrum.00598-22
Forskere fra University Hospital Frankfurt og Goethe University Frankfurt har afsløret, hvordan bakterier klæber til værtsceller, og dermed taget det første skridt mod at udvikle en ny klasse af antibiotika.
Bakteriers vedhæftning til værtsceller er altid det første, afgørende skridt i udviklingen af infektionssygdomme. Formålet med denne adhæsion af infektiøse patogener er at kolonisere værtsorganismen (f.eks. den menneskelige krop) og derefter udløse en infektion, som i værste fald kan ende dødeligt. En præcis forståelse af bakteriernes adhæsion til værtsceller er nøglen til at finde terapeutiske alternativer, der blokerer denne kritiske interaktion på det tidligst mulige stadie af en infektion.
Kritisk interaktion med det humane protein fibronectin
I samarbejde med andre forskere har forskere fra University Hospital Frankfurt og Goethe University Frankfurt nu forklaret den nøjagtige bakterielle adhæsionsmekanisme ved hjælp af den humanpatogene bakterie Bartonella henselae. Dette patogen forårsager "cat-scratch disease", en sygdom, der overføres fra dyr til mennesker. I et internationalt samarbejdsprojekt ledet af forskergruppen i Frankfurt ledet af professor Volkhard Kempf, blev den bakterielle adhæsionsmekanisme dechifreret ved hjælp af en kombination af in vitro adhæsionstest og high-throughput proteomics. Proteomics er studiet af alle de proteiner, der findes i en celle eller en kompleks organisme.
I deres undersøgelse offentliggjort i Microbiology Spectrum , kaster forskerne lys over en nøglemekanisme:den bakterielle adhæsion til værtscellerne kan spores tilbage til interaktionen af en bestemt klasse af adhæsiner – kaldet "trimeriske autotransporter adhæsiner" – med fibronectin, et protein, der ofte findes i humant væv. Adhæsiner er komponenter på overfladen af bakterier, der gør det muligt for patogenet at klæbe til værtens biologiske strukturer. Homologer af adhæsinet, der her identificeres som kritisk, er også til stede i mange andre humanpatogene bakterier, såsom den multiresistente Acinetobacter baumannii, som Verdenssundhedsorganisationen (WHO) har klassificeret som topprioritet for forskning i nye antibiotika.
State-of-the-art proteinanalyse blev brugt til at visualisere de nøjagtige punkter for interaktion mellem proteinerne. Derudover var det muligt at vise, at eksperimentel blokering af disse processer næsten helt forhindrer bakteriel adhæsion. Terapeutiske tilgange, der sigter mod at forhindre bakteriel adhæsion på denne måde, kunne repræsentere et lovende behandlingsalternativ som en ny klasse af antibiotika (kendt som "anti-ligander") i det konstant voksende domæne af multi-resistente bakterier.
 Varme artikler
Varme artikler
-
 Invasive krybdyr- og paddearter forårsager skader for milliarder af dollars globaltInvasive fremmede arter er en voksende bekymring for både miljøet og økonomien. Kredit:Shutterstock Økonomisk vækst og globalisering har forbundet verdens fjerneste steder. Hurtig handel og transpo
Invasive krybdyr- og paddearter forårsager skader for milliarder af dollars globaltInvasive fremmede arter er en voksende bekymring for både miljøet og økonomien. Kredit:Shutterstock Økonomisk vækst og globalisering har forbundet verdens fjerneste steder. Hurtig handel og transpo -
 Er pesticider, der bruges i by- og forstæder, til skade for honningbier?Administrerede honningbier. Kredit:Bianca Ackermann, public domain Selvom forskning har afsløret potentielle virkninger af pesticider fra landbrugsaktiviteter på honningbiers sundhed, har få unders
Er pesticider, der bruges i by- og forstæder, til skade for honningbier?Administrerede honningbier. Kredit:Bianca Ackermann, public domain Selvom forskning har afsløret potentielle virkninger af pesticider fra landbrugsaktiviteter på honningbiers sundhed, har få unders -
 Kan du virkelig skræmme nogen ihjel?Synes du, at en bjørn i naturen er skræmmende? Prøv en bjørn til morgenmad. Se flere følelsesbilleder. Billedkilde/Getty Images Du opretter en campingplads med dine venner, drømmer om sene aftener og
Kan du virkelig skræmme nogen ihjel?Synes du, at en bjørn i naturen er skræmmende? Prøv en bjørn til morgenmad. Se flere følelsesbilleder. Billedkilde/Getty Images Du opretter en campingplads med dine venner, drømmer om sene aftener og -
 Opdrætsresistente kyllinger for forbedret fødevaresikkerhedEn ny blodprøve, der identificerer kyllinger med medfødt immunitet over for patogener, kan hjælpe med at opdrætte mere robuste flokke for at forbedre forbrugernes fødevaresikkerhed. Kredit:Agricultura
Opdrætsresistente kyllinger for forbedret fødevaresikkerhedEn ny blodprøve, der identificerer kyllinger med medfødt immunitet over for patogener, kan hjælpe med at opdrætte mere robuste flokke for at forbedre forbrugernes fødevaresikkerhed. Kredit:Agricultura
- Leverandører i det sydlige Californien lærer at tilpasse sig afmatningen i satellitordrer
- Sådan finder du graderne i en cirkel
- Forskere finder en høj intensitet af hydrofluorcarbonemissioner i Yangtze River Delta-regionen
- Hvorfor er Styrofoam en god isolator?
- NASAs New Horizons når en sjælden rummilepæl
- Japans rumsonde kaster hoppende rovers mod asteroide


