Hvad ville være kogepunktet på 3,60 mol vandig saccharoseopløsning?
forståelse af konceptet
* kogepunkthøjde: Når et opløst stof (som saccharose) opløses i et opløsningsmiddel (som vand), øges kogepunktet for opløsningen sammenlignet med det rene opløsningsmiddel. Dette er kendt som kogepunkthøjde.
* molalitet: Koncentrationen af opløsningen udtrykkes i molalitet (mol opløst stof pr. Kg opløsningsmiddel). Vi er nødt til at kende molaliteten for at beregne kogepunkthøjden.
* formlen: Kogepunkthøjden (ΔT B ) beregnes ved hjælp af følgende formel:
ΔT b =K b * m
Hvor:
* ΔT b Er kogepunkthøjden
* K b er molal kogepunkthøjde konstant (for vand, k b =0,512 ° C/m)
* m er molaliteten af opløsningen
Beregninger
1. Antag en masse vand: For enkelhedsgraden, lad os antage, at vi har 1 kg (1000 g) vand.
2. Beregn molalitet:
* Mol sucrose =3,60 mol
* Masse vand =1 kg
* Molalitet (m) =(3,60 mol) / (1 kg) =3,60 mol / kg
3. Beregn kogepunkthøjde:
* ΔT b =(0,512 ° C/m) * (3,60 mol/kg) =1,84 ° C
4. Bestem kogepunktet:
* Det normale kogepunkt af vand er 100 ° C.
* Kogepunktet for opløsningen er 100 ° C + 1,84 ° C =101,84 ° C
Derfor ville kogepunktet på en vandig saccharoseopløsning på 3,60 mol være ca. 101,84 ° C.
Vigtige noter:
* Denne beregning antager den ideelle opførsel af løsningen, hvilket betyder, at der ikke er nogen signifikante interaktioner mellem opløsningsmiddel- og opløsningsmiddelmolekyler, der vil påvirke kogepunktet.
* I virkeligheden kan det faktiske kogepunkt afvige lidt på grund af ikke-ideel opførsel.
* Det er vigtigt at arbejde med molaliteten af opløsningen, ikke molaritet, når man beregner kogepunkthøjde. Molalitet er baseret på massen af opløsningsmidlet, som forbliver konstant uanset temperaturændringer.
Sidste artikelHvordan vidste forskere, at ilt var et nyt element?
Næste artikelHvad betyder isotonisk for miljøet?
 Varme artikler
Varme artikler
-
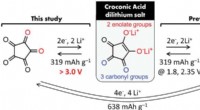 Et 4 V-klasse metalfrit organisk lithium-ion-batteri kommer tættere på virkeligheden3,0 V. Kredit:Advanced Science (2022). DOI:10.1002/advs.202200187 Et fælles forskerhold fra Tohoku University og University of California, Los Angeles (UCLA) har gjort et betydeligt fremskridt hen
Et 4 V-klasse metalfrit organisk lithium-ion-batteri kommer tættere på virkeligheden3,0 V. Kredit:Advanced Science (2022). DOI:10.1002/advs.202200187 Et fælles forskerhold fra Tohoku University og University of California, Los Angeles (UCLA) har gjort et betydeligt fremskridt hen -
 En nøgle til calciumsignalering:Struktur af den humane IP3R type 3 i sin ligandfri tilstandKredit:CC0 Public Domain IP3-receptorer (IP3Rer) er calciumkanaler, der findes i alle dyreceller. Ved at formidle frigivelse af calciumioner, IP3Rer integrerer signaler fra forskellige cellulære v
En nøgle til calciumsignalering:Struktur af den humane IP3R type 3 i sin ligandfri tilstandKredit:CC0 Public Domain IP3-receptorer (IP3Rer) er calciumkanaler, der findes i alle dyreceller. Ved at formidle frigivelse af calciumioner, IP3Rer integrerer signaler fra forskellige cellulære v -
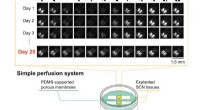 Hjernevæv holdt i live i ugevis på en kunstig membranNederst:mikroenhedsopsætningen med eksplanteret suprachiasmatic nucleus (SCN) væv. Øverst:rytmisk døgnaktivitet var stadig tydelig efter 25 dage, som angivet ved bioluminescensbilleddannelse. Kredit:R
Hjernevæv holdt i live i ugevis på en kunstig membranNederst:mikroenhedsopsætningen med eksplanteret suprachiasmatic nucleus (SCN) væv. Øverst:rytmisk døgnaktivitet var stadig tydelig efter 25 dage, som angivet ved bioluminescensbilleddannelse. Kredit:R -
 Ny formhukommelsespolymer repræsenterer biomedicinsk gennembrudProfessor James H. Henderson og ph.d. kandidat Shelby L. Buffington. Kredit:Syracuse University Forskere fra College of Engineering and Computer Science har udviklet et materiale - en ny slags for
Ny formhukommelsespolymer repræsenterer biomedicinsk gennembrudProfessor James H. Henderson og ph.d. kandidat Shelby L. Buffington. Kredit:Syracuse University Forskere fra College of Engineering and Computer Science har udviklet et materiale - en ny slags for
- Hvorfor stiger presset fra en gas, når temperaturen øges?
- Hvordan kommer kuldioxid ind i en plantecelle?
- Hvad er en sedimentær klippe dannet af aflejringer af skaller kaldet?
- Det britiske frackingfirma producerer den første skifergas
- Bakteriemodel hjælper med at afsløre, hvordan vores kroppe forhindrer befolkningseksplosioner - og…
- Hvordan er livsvidenskab og fysisk det samme?


