Hvad siger loven om entalpien af en reaktion?
Her er hvad det siger:
Hess's lov: Enthalpyændringen af en reaktion er uafhængig af den vej, der er taget. Dette betyder, at den samlede entalpi -ændring for en reaktion er den samme, uanset om det forekommer i et trin eller en række trin.
Sådan gælder det for entalpi:
* entalpiændring (ΔH): Hess's lov fortæller os, at den samlede entalpi -ændring for en reaktion er summen af entalpienændringerne for hvert enkelt trin i reaktionen.
* Standard entalpi af dannelse (ΔHF °): Dette er entalpiændringen, når en mol af en forbindelse dannes fra dens elementer i deres standardtilstande. Hess's lov giver os mulighed for at beregne den standard entalpi af dannelse for en forbindelse ved hjælp af kendt standard entalpi af dannelsesværdier for andre forbindelser involveret i reaktionen.
* Beregning af entalpiændringer: Hess's lov er et kraftfuldt værktøj til beregning af entalpiændringer for reaktioner, der er vanskelige eller umulige at måle direkte. Vi kan opdele en kompleks reaktion i enklere trin med kendte entalpiændringer og derefter bruge Hess's lov til at beregne den samlede entalpi -ændring.
Eksempel:
Forestil dig, at du vil finde enthalpiændringen til forbrænding af metan (CH4). Du kan direkte måle det i et kalorimeter, men du kan også beregne det ved hjælp af Hess's lov:
1. Trin 1: CH4 (G) + 2O2 (G) → CO2 (G) + 2H2O (L)
* Dette er den samlede reaktion.
2. Trin 2: C (S) + O2 (G) → CO2 (G)
* Dette er forbrænding af kulstof med en kendt ΔH.
3. Trin 3: 2H2 (g) + O2 (g) → 2H2O (L)
* Dette er forbrænding af brint med en kendt ΔH.
Ved hjælp af Hess's lov kan du kombinere entalpiændringerne fra trin 2 og 3 for at beregne entalpiændringen for trin 1 (forbrænding af metan).
Sammenfattende er Hess's lov en grundlæggende lov inden for termodynamik, der giver os mulighed for at forstå og beregne entalpiændringerne forbundet med kemiske reaktioner.
Sidste artikelHvad er entalpien af reaktionen-?
Næste artikelHvad er den kemiske formel til opvaskesæbe og vand?
 Varme artikler
Varme artikler
-
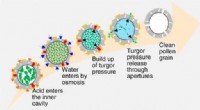 Rensning af pollenskallerKredit:American Chemical Society Efterhånden som allergisæsonen intensiveres, mange mennesker forbander pollen - det pulveragtige stof, der frigives af planter til reproduktion. Imidlertid, pollen
Rensning af pollenskallerKredit:American Chemical Society Efterhånden som allergisæsonen intensiveres, mange mennesker forbander pollen - det pulveragtige stof, der frigives af planter til reproduktion. Imidlertid, pollen -
 Gulerodscement:Hvordan rodfrugter og aske kunne gøre beton mere bæredygtigBeton er ansvarlig for 8% af de globale drivhusgasemissioner og er det næstmest anvendte stof i verden. Kredit:Harry Dona/Unsplash Beton er blevet vores foretrukne byggemateriale til utallige kons
Gulerodscement:Hvordan rodfrugter og aske kunne gøre beton mere bæredygtigBeton er ansvarlig for 8% af de globale drivhusgasemissioner og er det næstmest anvendte stof i verden. Kredit:Harry Dona/Unsplash Beton er blevet vores foretrukne byggemateriale til utallige kons -
 Grønnere brint fra vandFeng Jiao, en lektor i kemisk og biomolekylær ingeniørvidenskab og associeret direktør for Center for Katalytisk Videnskab og Teknologi ved UD, i sit laboratorium. Kredit:University of Delaware Id
Grønnere brint fra vandFeng Jiao, en lektor i kemisk og biomolekylær ingeniørvidenskab og associeret direktør for Center for Katalytisk Videnskab og Teknologi ved UD, i sit laboratorium. Kredit:University of Delaware Id -
 Video:Den mærkelige kemi, der truer mesterværksmalerierKredit:The American Chemical Society En god kunsthandler kan virkelig rydde op på dagens marked, men ikke når en eller anden underlig kemi ødelægger mesterværker. Kunstkonservatorer begyndte at l
Video:Den mærkelige kemi, der truer mesterværksmalerierKredit:The American Chemical Society En god kunsthandler kan virkelig rydde op på dagens marked, men ikke når en eller anden underlig kemi ødelægger mesterværker. Kunstkonservatorer begyndte at l
- Mål for bæredygtig udvikling har brug for et sidste skub med kun 10 år tilbage
- Lange tryner beskytter ræve, når de dykker med hovedet først ned i sneen, viser undersøgelse
- Thomas Hunt Morgan grupperede Drosophila -generne, der var inheiritedtogether i fire, hvilke grupper…
- FNs videnskabspanelchef opfordrer til mere handling for at dæmme op for opvarmningen
- Ny indsigt i, hvordan bier bekæmper dødbringende varroamide ved at pleje dem
- Truede planter og dyr List


