Hvad er entalpien af reaktionen-?
entalpi af reaktion:
entalpien af reaktion , også kendt som Ændring i entalpi , er mængden af varme, der absorberes eller frigives under en kemisk reaktion, der udføres ved konstant tryk. Det er et grundlæggende koncept inden for termodynamik og er repræsenteret af symbolet ΔH .
Her er en sammenbrud:
* varme: En form for energi, der overføres mellem objekter eller systemer på grund af en temperaturforskel.
* Absorption: Når en reaktion * absorberer * varme, er det endotermisk , og ΔH er positiv.
* Udgivelse: Når en reaktion * frigiver * varme, er den eksoterm , og ΔH er negativ.
hvordan det beregnes:
* ΔH =h produkter - H reaktanter
* H produkter er entalpien af produkterne.
* H reaktanter er entalpien af reaktanterne.
Vigtige punkter:
* Entalpi af reaktion er en tilstandsfunktion , hvilket betyder, at det kun afhænger af de oprindelige og endelige tilstande i systemet, ikke den sti, der er taget.
* Det udtrykkes normalt i kj/mol (Kilojoules pr. Mol).
* Standard entalpi af reaktion (ΔH °) Henviser til ændringen i entalpi, når reaktionen forekommer under standardbetingelser (298 K og 1 ATM -tryk).
Ansøgninger:
* At forudsige, om en reaktion vil være eksoterm eller endotermisk.
* Beregning af mængden af varme, der er absorberet eller frigivet i en reaktion.
* Forståelse af energiændringerne forbundet med kemiske processer.
Eksempler:
* forbrænding: Brændende brændstoffer frigiver varme, så entalpien af forbrænding er negativ (eksoterme).
* Fotosyntese: Planter absorberer sollys for at omdanne kuldioxid og vand til glukose, hvilket gør entalpien af fotosyntesen positiv (endotermisk).
I resuméet fortæller entalpien af reaktion os, hvor meget varme der er involveret i en kemisk reaktion, og om reaktionen frigiver eller absorberer energi. Det er et afgørende koncept i forståelsen af energibalancen i kemiske processer.
Sidste artikelHvad har en positiv ladning og findes i midten af et atom?
Næste artikelHvad siger loven om entalpien af en reaktion?
 Varme artikler
Varme artikler
-
 Overgangsmetalkomplekser:Blandet virker bedreIllustrationen viser et molekyle med et jernatom i centrum, bundet til 4 CN-grupper og et bipyridinmolekyle. Den højeste besatte jernbane er vist som en grøn-rød sky. Så snart en cyan gruppe er til st
Overgangsmetalkomplekser:Blandet virker bedreIllustrationen viser et molekyle med et jernatom i centrum, bundet til 4 CN-grupper og et bipyridinmolekyle. Den højeste besatte jernbane er vist som en grøn-rød sky. Så snart en cyan gruppe er til st -
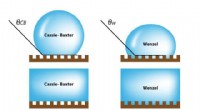 Forståelse af overfladevidenskab til fremstilling af kosmetik af høj kvalitetBefugtningsovergangen fra Cassie-Baxter-tilstand til Wenzel-tilstand på strukturerede overflader. Kredit:UNIST Et forskerhold tilknyttet UNIST har undersøgt hastighederne for væskepenetration på r
Forståelse af overfladevidenskab til fremstilling af kosmetik af høj kvalitetBefugtningsovergangen fra Cassie-Baxter-tilstand til Wenzel-tilstand på strukturerede overflader. Kredit:UNIST Et forskerhold tilknyttet UNIST har undersøgt hastighederne for væskepenetration på r -
 Selvsamlende proteinfilamenter designet og bygget fra bundenNy, computerdesignede proteiner samler sig selv til filamenter mere end tusind gange tyndere end et menneskehår. Kredit:Ian C. Haydon/Institute for Protein Design For første gang, videnskabsmænd h
Selvsamlende proteinfilamenter designet og bygget fra bundenNy, computerdesignede proteiner samler sig selv til filamenter mere end tusind gange tyndere end et menneskehår. Kredit:Ian C. Haydon/Institute for Protein Design For første gang, videnskabsmænd h -
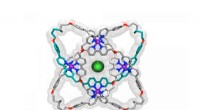 Molekylær knude vinder rekord for verdens strammesteRøntgenkrystalstruktur af en molekylær knude med otte krydsninger. Kredit:Jean-Francois Lemonnier, University of Manchester Forskere ved University of Manchester fejrer efter at være blevet rekord
Molekylær knude vinder rekord for verdens strammesteRøntgenkrystalstruktur af en molekylær knude med otte krydsninger. Kredit:Jean-Francois Lemonnier, University of Manchester Forskere ved University of Manchester fejrer efter at være blevet rekord


