Hvorfor danner elementerne natrium- og kalium -ioner med samme ladning?
Her er hvorfor:
* Elektronkonfiguration: Natrium (NA) har elektronkonfigurationen [NE] 3S¹ og kalium (K) har elektronkonfigurationen [AR] 4S¹. Dette betyder, at de begge har et enkelt elektron i deres yderste (valence) skal.
* stabilitet: Atomer stræber efter en stabil elektronkonfiguration, der ligner den nærmeste ædle gas. Noble gasser har en fuld yderste skal, hvilket gør dem usædvanligt ureaktive. For natrium og kalium resulterer mister deres enkelt valenselektron i en fyldt ydre skal, der efterligner henholdsvis elektronkonfigurationen af Neon (NE) og argon (AR).
* iondannelse: Ved at miste en elektron bliver natrium og kalium positivt ladede ioner (kationer):
* Na → Na⁺ + E⁻
* K → k⁺ + e⁻
Derfor på grund af deres lignende elektronkonfigurationer og deres tendens til at opnå stabilitet ved at miste en enkelt elektron, både natrium- og kaliumform +1 -ioner.
Sidste artikelHvad er 38,6cin Fahrenheit?
Næste artikelHvad er brugen af Koplin Jar i laboratoriet?
 Varme artikler
Varme artikler
-
 Forståelse af gasflow for forbedrede anvendelser af ren energiFig.1:Strømlininger af gasstrømning gennem et porøst medium induceret af påført trykgradient ∇p. Farven på strømlinjer repræsenterer styrken af strømningshastigheden, hvor rød repræsenterer hurtig h
Forståelse af gasflow for forbedrede anvendelser af ren energiFig.1:Strømlininger af gasstrømning gennem et porøst medium induceret af påført trykgradient ∇p. Farven på strømlinjer repræsenterer styrken af strømningshastigheden, hvor rød repræsenterer hurtig h -
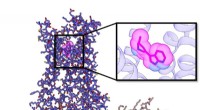 Forskere skaber ikke-psykedeliske forbindelser med samme antidepressive effektRepræsentation af serotonin 2A-receptoren (5HT2AR) signalerende proteinkompleks bundet til den nye forbindelse R-69 (i undergruppe, magenta). Kredit:Roth Lab, UNC School of Medicine Selvom det er u
Forskere skaber ikke-psykedeliske forbindelser med samme antidepressive effektRepræsentation af serotonin 2A-receptoren (5HT2AR) signalerende proteinkompleks bundet til den nye forbindelse R-69 (i undergruppe, magenta). Kredit:Roth Lab, UNC School of Medicine Selvom det er u -
 At omdanne træbark og kompost til flyvinger og plastikposerBiopolymerer afledt af træer og afgrøder bruges allerede til at fremstille bilinteriør. Kredit:Monsterkoi / Pixabay Træer, afgrøder og endda organisk affald kan omdannes til en forvirrende række a
At omdanne træbark og kompost til flyvinger og plastikposerBiopolymerer afledt af træer og afgrøder bruges allerede til at fremstille bilinteriør. Kredit:Monsterkoi / Pixabay Træer, afgrøder og endda organisk affald kan omdannes til en forvirrende række a -
 Forskere opdager molekyler usædvanlige celle-dræbende mekanismeKredit:Susanna M. Hamilton, Bred kommunikation Kort efter at Jake Eaton kom til Stuart Schreibers laboratorium på Broad Institute of MIT og Harvard i 2015, postdoc-forskeren blev fascineret af nog
Forskere opdager molekyler usædvanlige celle-dræbende mekanismeKredit:Susanna M. Hamilton, Bred kommunikation Kort efter at Jake Eaton kom til Stuart Schreibers laboratorium på Broad Institute of MIT og Harvard i 2015, postdoc-forskeren blev fascineret af nog
- Ny billedbehandlingsfunktion afslører mulig nøgle til at forlænge batteriets levetid, kapacitet
- Ansigt til ansigt-workshops øger husstandens beredskab til katastrofer
- Hvilken gas er nødvendig for cellulær respiration?
- Hvad er volumen i ballon ved 240 grader Celsius?
- Sådan bruges en Neon Transformer
- Sådan skriver du kvadratiske ligninger i Vertex Form


