Hvad sker der, når saltsyre reagerer med natriumhydroxid?
Den kemiske ligning:
HCL (aq) + NaOH (aq) → NaCl (aq) + h₂o (l)
Forklaring:
* reaktanter:
* saltsyre (HCL) er en stærk syre, hvilket betyder, at den let donerer hydrogenioner (H⁺) i opløsning.
* natriumhydroxid (NaOH) er en stærk base, hvilket betyder, at den let accepterer hydrogenioner (H⁺) i opløsning og tilvejebringer hydroxidioner (OH⁻).
* Produkter:
* natriumchlorid (NaCl) er et salt, dannet af kombinationen af natriumkation (Na⁺) fra NaOH og chloridanionen (CL⁻) fra HCI. Det opløses i vand.
* vand (H₂O) dannes af kombinationen af hydrogenioner (H⁺) fra HCI- og hydroxidioner (OH⁻) fra NaOH.
Hvad sker der i løsning:
1. ionisering: HCl og NaOH dissocierer fuldstændigt i vand og danner ioner:
* HCL → H⁺ + cl⁻
* NaOH → Na⁺ + OH⁻
2. neutralisering: Hydrogenionerne (H⁺) fra syren reagerer med hydroxidionerne (OH⁻) fra basen til dannelse af vand (H₂O):
* H⁺ + OH⁻ → H₂O
3. saltdannelse: De resterende ioner, natrium (Na⁺) og chlorid (CL⁻), kombineres til dannelse af natriumchlorid (NaCl), der opløses i vand.
Nøglefunktioner ved reaktionen:
* eksotermisk: Reaktionen frigiver varme, hvilket gør opløsningen varmere.
* neutralisering: Reaktionen neutraliserer de sure og grundlæggende egenskaber for reaktanterne, hvilket resulterer i en opløsning tættere på neutral pH.
* saltdannelse: Reaktionen producerer et salt, som er en forbindelse dannet ved reaktionen af en syre og en base.
Praktiske applikationer:
Denne reaktion bruges i:
* Kemisk analyse: At bestemme koncentrationen af syrer eller baser.
* Industrielle processer: For at justere pH af opløsninger.
* hverdag: I produktionen af sæbe og vaskemidler.
 Varme artikler
Varme artikler
-
 Bipolar orden:En ligetil teknik til at have mere kontrol over organiske tynde filmKombinationen af bipolar elektrokemi med elektrolytisk micelforstyrrelse fører til fremstilling af formede organiske tynde film. Fremgangsmåden indebærer trådløs fremkaldelse af en ønsket potentialf
Bipolar orden:En ligetil teknik til at have mere kontrol over organiske tynde filmKombinationen af bipolar elektrokemi med elektrolytisk micelforstyrrelse fører til fremstilling af formede organiske tynde film. Fremgangsmåden indebærer trådløs fremkaldelse af en ønsket potentialf -
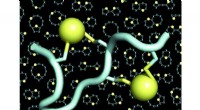 Dobbeltbroede peptider binder ethvert sygdomsmålEn model af et dobbeltbrokoblet peptid (peptidet i lyseblåt, de to broer i gult). Baggrunden for figurerne viser mange eksempler på skeletter (også kaldet stilladser eller rygrade) af dobbeltbroforbun
Dobbeltbroede peptider binder ethvert sygdomsmålEn model af et dobbeltbrokoblet peptid (peptidet i lyseblåt, de to broer i gult). Baggrunden for figurerne viser mange eksempler på skeletter (også kaldet stilladser eller rygrade) af dobbeltbroforbun -
 Bedre og billigere sundhedspleje med tørre blodprøverEn dråbe blod på filterpapir til fremtidig diagnostik. Kredit:Johan Björkesten Tørret blod på filterpapir opbevaret til fremtidige diagnostiske formål-betydeligt lettere end i dag, ressourceforbru
Bedre og billigere sundhedspleje med tørre blodprøverEn dråbe blod på filterpapir til fremtidig diagnostik. Kredit:Johan Björkesten Tørret blod på filterpapir opbevaret til fremtidige diagnostiske formål-betydeligt lettere end i dag, ressourceforbru -
 Superdiamond carbon-bor bure kan fange og udnytte forskellige egenskaberKlatratstrukturen af todelt sodalit-type, som består af trunkerede oktaedriske værts-bure, der fanger strontium-gæste-atomer, blev syntetiseret under højtryks- og højtemperaturforhold ved hjælp af e
Superdiamond carbon-bor bure kan fange og udnytte forskellige egenskaberKlatratstrukturen af todelt sodalit-type, som består af trunkerede oktaedriske værts-bure, der fanger strontium-gæste-atomer, blev syntetiseret under højtryks- og højtemperaturforhold ved hjælp af e
- Når hanbier ikke er heldige:En sammenhæng mellem fenbuconazol og parringsadfærd
- Retten bestemmer, at Apple skal betale arbejdere i Californien under taskecheck
- Microfluidics hjælper ingeniører med at se virusinfektion i realtid
- Hvor er jordskælv eller vulkaner sandsynligvis?
- Hvad er forskellen mellem GEV- og MEV -elektronbolte?
- Projekt sætter jernbanekommunikationsnetværk på rette spor


