Kan mængden af gas påvirke trykgassen?
pv =nrt
Hvor:
* p er pres
* v er volumen
* n er antallet af mol gas (som er direkte proportional med mængden af gas)
* r er den ideelle gaskonstant
* t er temperatur
Lad os nedbryde det:
* Direkte forhold: Ligningen viser et direkte forhold mellem tryk (P) og antallet af mol gas (N). Dette betyder, at øgning af gasmængden vil øge trykket, forudsat at volumen og temperaturen forbliver konstant.
* Forestil dig en container: Tænk på en beholder med et fast volumen. Hvis du tilføjer flere gasmolekyler, vil de kollidere med containervæggene hyppigere, hvilket øger trykket.
* Eksempler:
* pumpe op et dæk: Du tilføjer mere luft (gas) til dækket, hvilket øger trykket.
* madlavning i en trykkoger: Trykket inde i komfuret stiger, når damp (vanddamp) opbygges.
Vigtig note: Den ideelle gaslov giver en god tilnærmelse for mange gasser under almindelige forhold. Imidlertid kan reelle gasser afvige fra denne lov ved høje tryk eller lave temperaturer.
 Varme artikler
Varme artikler
-
 Planter modellerer mere effektiv termisk afkølingsmetodePatricia Weisensee og hendes laboratorium studerede temperaturen og fordampningsadfærden af en dråbe fastgjort til en lodret overflade. Kredit:Weisensee Lab Når vanddråber rører overfladen af
Planter modellerer mere effektiv termisk afkølingsmetodePatricia Weisensee og hendes laboratorium studerede temperaturen og fordampningsadfærden af en dråbe fastgjort til en lodret overflade. Kredit:Weisensee Lab Når vanddråber rører overfladen af -
 Frøet, der kunne bringe rent vand til millioner(venstre) Uskallede M. oleifera frø, (mellem) afskallede frø, (til højre) knuste frø før proteinekstraktion Kredit:Carnegie Mellon University College of Engineering Ifølge FN, 2,1 milliarder menne
Frøet, der kunne bringe rent vand til millioner(venstre) Uskallede M. oleifera frø, (mellem) afskallede frø, (til højre) knuste frø før proteinekstraktion Kredit:Carnegie Mellon University College of Engineering Ifølge FN, 2,1 milliarder menne -
 Oprettelse af lithium-ion-batterier med højere energitæthed til vedvarende energianvendelserI den Journal of Vacuum Science and Technology A , forskere undersøger oprindelsen af nedbrydning i LIB-katodematerialer med høj energitæthed og udvikler strategier til at afbøde disse nedbrydning
Oprettelse af lithium-ion-batterier med højere energitæthed til vedvarende energianvendelserI den Journal of Vacuum Science and Technology A , forskere undersøger oprindelsen af nedbrydning i LIB-katodematerialer med høj energitæthed og udvikler strategier til at afbøde disse nedbrydning -
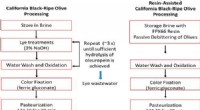 En grønnere måde at tage bitterheden ud af olivenKredit:American Chemical Society Oliven er en del af middelhavskosten, som har været forbundet med en reduceret forekomst af hjerte-kar-sygdomme, Alzheimers sygdom og andre tilstande. Imidlertid,
En grønnere måde at tage bitterheden ud af olivenKredit:American Chemical Society Oliven er en del af middelhavskosten, som har været forbundet med en reduceret forekomst af hjerte-kar-sygdomme, Alzheimers sygdom og andre tilstande. Imidlertid,
- Hvilke organismer spredes af vind?
- En massiv kollision i Mælkevejene fortiden
- Skal magmatisk bjergart blive sedimentært, før det kan metamorfe bjergarter?
- FN forudser endnu varmere temperaturer i løbet af de næste 5 år
- Sådan beregnes fastgørelseselementet Pullout
- Genoprettende retfærdighed foretrukket blandt Enga i Papua Ny Guinea


