Hvorfor skal kun frisklavet opløsning af jernsulfat anvendes?
* Oxidation: Jernsulfat oxideres let med luft, hvilket betyder, at det reagerer med ilt. Denne oxidationsproces konverterer jernholdige ioner (Fe 2+ ) til ferriske ioner (Fe 3+ ), ændring af den kemiske sammensætning af opløsningen. Ferrisulfat (Fe 2 (Så 4 ) 3 ) er mindre effektiv til mange anvendelser sammenlignet med jernsulfat.
* nedbør: Over tid kan jernholdige sulfatopløsninger danne bundfald, som er faste partikler, der sætter sig ud af opløsningen. Denne nedbør forekommer på grund af reaktionen af jernholdige ioner med hydroxidioner i opløsningen og danner uopløselig jernholdigt hydroxid (Fe (OH) 2 ).
* Nøjagtighed og pålidelighed: Tilstedeværelsen af jernioner og bundfald kan påvirke nøjagtigheden og pålideligheden af eksperimenter eller anvendelser, der er afhængige af en specifik koncentration af jernholdige ioner. For eksempel i analytisk kemi kan ved anvendelse af en opløsning med en ukendt og varierende koncentration af jernholdige ioner føre til unøjagtige resultater.
* stabilitet: Jernsulfatopløsninger er ikke stabile over tid, især i nærvær af lys og varme. Frisk forberedte opløsninger sikrer den maksimale koncentration af jernholdige ioner og minimal nedbrydning.
Derfor, for nøjagtige og pålidelige resultater og optimal ydeevne, er det vigtigt at bruge en frisklavet opløsning af jernsulfat.
Her er nogle almindelige applikationer, hvor det anbefales at bruge en frisklavet løsning:
* titrering: Til nøjagtig analyse i titreringer, hvor koncentrationen af jernholdige ioner skal kendes nøjagtigt.
* Kemiske reaktioner: Som et reduktionsmiddel i kemiske reaktioner, hvor dets reaktivitet er afgørende.
* havearbejde: Til behandling af jernmangel i planter, da effektiviteten af opløsningen afhænger af tilgængeligheden af jernholdige ioner.
* Farmaceutiske anvendelser: I formuleringer, hvor jernsulfatkoncentrationen skal kontrolleres til medicinske formål.
Husk, at de specifikke krav til brug af en frisklavet løsning kan variere afhængigt af applikationen og den tilsigtede anvendelse af løsningen.
 Varme artikler
Varme artikler
-
 Skatteregel for industrien belønner kulstofopsamlingKredit:CC0 Public Domain Når det kommer til at tilskynde producenter til at reducere deres kuldioxid (CO 2 ) emissioner, en gulerod kan være mere effektiv end en pind. Det er den tilgang, der er
Skatteregel for industrien belønner kulstofopsamlingKredit:CC0 Public Domain Når det kommer til at tilskynde producenter til at reducere deres kuldioxid (CO 2 ) emissioner, en gulerod kan være mere effektiv end en pind. Det er den tilgang, der er -
 Ny proces fremskynder lægemiddelbehandlinger for virusinfektioner og kræftKredit:Simon Fraser University At opdage antivirale og anticancermedicin vil snart være hurtigere og billigere takket være ny forskning fra Simon Fraser University kemiker Robert Britton og hans i
Ny proces fremskynder lægemiddelbehandlinger for virusinfektioner og kræftKredit:Simon Fraser University At opdage antivirale og anticancermedicin vil snart være hurtigere og billigere takket være ny forskning fra Simon Fraser University kemiker Robert Britton og hans i -
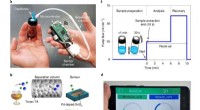 Bærbar smartphone-tilføjelse kan måle methanol i alkoholholdige drikkevarerAnalysator design. en, Den håndholdte analysator under måling. b, En skematisk oversigt over detekteringskonceptet. c, Prøveudtagning og analyseprocedure. d, Den skræddersyede app til at visualisere r
Bærbar smartphone-tilføjelse kan måle methanol i alkoholholdige drikkevarerAnalysator design. en, Den håndholdte analysator under måling. b, En skematisk oversigt over detekteringskonceptet. c, Prøveudtagning og analyseprocedure. d, Den skræddersyede app til at visualisere r -
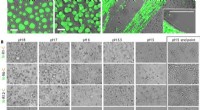 Væske-væske faseadskillelse fundet at drive processen med at konvertere spidroin-proteiner til edd…Forsuring udløser hurtig selvsamling af MaSp2 nanofibriller. (A) N-R12-C mærket med DyLight 488 (10 til 20 mg ml-1 slutkoncentration) blev blandet ind i 0,5 M KPi ved de angivne pH-værdier og visualis
Væske-væske faseadskillelse fundet at drive processen med at konvertere spidroin-proteiner til edd…Forsuring udløser hurtig selvsamling af MaSp2 nanofibriller. (A) N-R12-C mærket med DyLight 488 (10 til 20 mg ml-1 slutkoncentration) blev blandet ind i 0,5 M KPi ved de angivne pH-værdier og visualis
- Forurening er et betydeligt problem i 401 nationalparker, siger rapporten
- Atomfusionsprojekt står over for forsinkelser over amerikanske budgetnedskæringer:direktør
- Video:Hvordan bly (måske) forårsagede det gamle Roms undergang
- Hvordan beskriver man elcotoromagnetiske bølger og nævner to typer elektromagnetiske bølger?
- Syntetiske kemikalier i jord er en tikkende bombe
- Hvordan kender forskere afstanden fra jord til måne?


