Hvad sker der med OH i en vandig løsning, når H3O øges?
Her er hvorfor:
* kW er en konstant: Det ioniske produkt af vand (KW) er en konstant ved en given temperatur. Det repræsenterer produktet af koncentrationerne af H3O+ og OH-ioner i vand. Ved 25 ° C, kW =1,0 x 10^-14.
* Inverse forhold: Ligningen for KW er:
Kw =[h3o+] [oh-]
* skift i ligevægt: Hvis koncentrationen af H3O+ øges, skifter ligevægten til venstre for at opretholde den konstante værdi af KW. Dette betyder, at koncentrationen af OH-skal falde for at kompensere for stigningen i H3O+.
i enklere termer:
Forestil dig en set. H3O+ og OH- er på modsatte ender. Når den ene side går op (H3O+ -koncentration øges), skal den anden side gå ned (OH-koncentration falder) for at opretholde balancen (KW konstant).
Derfor fører stigende H3O+ i en vandig opløsning til et fald i OH-koncentration. Dette gør løsningen mere sure .
 Varme artikler
Varme artikler
-
 Molekylær kortlægning gjort let3D-kort over molekylerne på en pengeautomat. Dette kort viser, hvordan vi overfører molekyler fra vores hud til de objekter, vi interagerer med, give oplysninger, der kan have mange retsmedicinske anv
Molekylær kortlægning gjort let3D-kort over molekylerne på en pengeautomat. Dette kort viser, hvordan vi overfører molekyler fra vores hud til de objekter, vi interagerer med, give oplysninger, der kan have mange retsmedicinske anv -
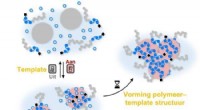 Tænd og sluk for polymeriseringsprocessen ved hjælp af en omskiftelig skabelonKredit:Bas van Ravensteijn Regulering af polymerisationsprocessen er af stor interesse for både industrielle og medicinske anvendelser. I en artikel publiceret i Angewandte Chemie TU/e-forskere vis
Tænd og sluk for polymeriseringsprocessen ved hjælp af en omskiftelig skabelonKredit:Bas van Ravensteijn Regulering af polymerisationsprocessen er af stor interesse for både industrielle og medicinske anvendelser. I en artikel publiceret i Angewandte Chemie TU/e-forskere vis -
 Bioluminescerende succinat -detektion overvåger dioxygenaser og JMJC -demethylaserDemethylering af DNA og Histon i Nucleosome af Demethylases. Kredit:Promega Corporation En ny (og frit tilgængelig) original forskningsartikel offentliggjort forud for print kl SLAS Discovery On
Bioluminescerende succinat -detektion overvåger dioxygenaser og JMJC -demethylaserDemethylering af DNA og Histon i Nucleosome af Demethylases. Kredit:Promega Corporation En ny (og frit tilgængelig) original forskningsartikel offentliggjort forud for print kl SLAS Discovery On -
 ORNL undersøger komplekse uranoxider med hjælp fra CADES ressourcerORNL-medarbejdere (fra venstre) Ashley Shields, Michael Galloway, Ketan Maheshwari og Andrew Miskowiec samarbejder om et projekt, der fokuserer på at forudsige og analysere krystalstrukturer af nye ur
ORNL undersøger komplekse uranoxider med hjælp fra CADES ressourcerORNL-medarbejdere (fra venstre) Ashley Shields, Michael Galloway, Ketan Maheshwari og Andrew Miskowiec samarbejder om et projekt, der fokuserer på at forudsige og analysere krystalstrukturer af nye ur
- Edward C. Baig:Galaxy Fold anmeldelse:5 ting at overveje som Samsungs andet forsøg $2, 000 telefone…
- Billeddannelsesgennembrud kan hjælpe udviklingen af kvantemikroskoper
- Et brændende kemisk anlæg kan være kun toppen af orkanen Lauras skader i dette område af olief…
- Achondrit fundet til at dateres tilbage til kun to millioner år efter fødslen af solsystemet
- Forstår den europæiske offentlighed virkningerne af klimaændringer på havet?
- Hvem udviklede det første bredt accepterede system med biologisk klassificering, han klassificerede…


